IBK투자증권에서 백신산업에 대한 In-depth 리포트가 발간됐다.

I. 글로벌 백신 시장 현황
2028년 글로벌 백신 시장 1,035억달러 규모로 성장할 것으로 예상
• 글로벌 백신 시장 규모는 2017년 기준 335억달러 규모, 2018년 364억달러, 2019년 396억달러, 올해에는 430억달러 규모로 성장 예상.
• 글로벌 고령화 현상 심화에 따른 감염 대상 취약 인구 증가세.
• 감염성 질환의 다양화 및 병원성 변종 바이러스의 출현으로 이에 대응하는 백신 시장은 매년 성장세.
• Next Generation 차세대 백신 개발에 따른 제품의 부가가치 상승(ex: Plasmid DNA백신, 항암 백신, 비병원성 바이러스 벡터 백신 등).

백신 접종 형태는 근육주사가 가장 큰 비중, 차세대 백신 개발에 따른 접종 경로 다양화
• 백신 접종 형태는 근육주사가 54%로 가장 큰 비중을 차지, 다음으로 피하주사 19%, 경구접종 11%, 정맥주사 9%로 구성.
• 차세대 백신 출현 및 더 효과적인 백신 개발이 진행되면서 정맥주사 형태의 접종이 증가하고 있음.
정맥주사는 백신 약물을 정맥으로 직접 투여하기 때문에 효과가 신속하게 나타나는 것이 특징.
특히 암 백신 개발이 활발하게 이루어지면서 암세포를 빠르고 효과적으로 제어할 수 있는 정맥 투여 백신 시장 비중이 더 커질 것으로 예상됨.
정맥 주사 형태의 접종 비중은 점진적으로 상승해 2025년에는 정맥 주사 비중이 12% 이상으로 증가할 것으로 전망.
• 폐렴 구균 백신 시장이 2019년 기준 7.5조원 규모로 가장 큰 시장을 구성하고 있으며 DTP(diphtheria, pertussis, tetanus: 디프테리아, 백일해, 파상풍)와 인플루엔자, 암, HPV, 수막구균, 간염 백신이 순서대로 시장 규모를 형성.
• 향후 암백신 시장이 가장 큰 성장세를 보여줄 것으로 전망.

치료용 백신 시장이 새롭게 떠오를 것
• 백신은 크게 예방백신(Prophylactic vaccine)과 치료백신(Therapeutic vaccine)으로 구분할 수 있음.
예방 백신은 말 그대로 건강한 일반인을 대상으로 질병의 예방을 위해 접종하며 치료 백신은 질병을 앓고 있는 환자를 대상으로 투약.
치료용 백신은 특히 환자수가 가파르게 증가하는 항암 영역에서 활발한 연구 개발이 이루어지고 있는 상황.
• 최초의 치료 백신으로는 2010년 FDA로부터 승인 받은 전립선암(prostate cancer) 치료제 Provenge(by Dendreon Pharmaceuticals)가 있음.
당시에는 치료 백신에 대한 개념이 명확하지 않던 시점으로 치료용 백신에 대한 활발한 투자는 최근에 본격화 되고 있는 상황.
• 항암 백신 신약 파이프라인의 수도 최근 가파르게 상승하며 전체 항암제 비중에서 10% 이상이 항암 백신으로 개발 중인 것으로 파악되며 향후 치료용 백신 시장은 예방용 백신 시장과 비교해서 가파르게 성장할 것으로 기대됨.

II. 글로벌 대표 백신 Players
백신 시장의 글로벌 대표 기업들 = 높은 코로나 백신 개발 가능성
• 백신 산업의 글로벌 대표 Top 4 기업은 Merck & Co, GSK, Pfizer, Sanofi.
• Top 4 기업의 글로벌 백신 시장 점유율은 약 85% 비중으로 과점 시장을 형성.
• 기타 15%를 구성하는 기업은 다양하며 글로벌 규모의 기업으로는 Abbott Laboratories, CSL Ltd, AstraZeneca, Emergent Biosolutions, Daiichi Sankyo, Janssen Pharmaceutica, Sinovac Biotech 등이 있음.
• 백신 대표 기업들의 백신 품목들은 대부분 감염병 백신으로 구성되어 있으며 특정 감염병에 대응하는 소수의 블록버스터 품목이 대부분의 매출을 발생시키고 있음.
• 글로벌 백신 Players는 감염병 백신을 CashCow 사업으로해서 최근에는 항암 및 치료용 백신 개발에 적극적인 투자를 진행중.

글로벌 대표 기업의 감염증 백신 사업은 안정적 CashCow 사업
• 글로벌 대표 백신 기업들은 시장 과점 지위를 기반으로 백신 사업부에서 안정적인 실적을 유지하고 있음.
• Pfizer는 글로벌 블록버스터 백신 Prevenar 13(폐렴구균 백신)이 연간 매출액 58억달러 규모.
Pfizer의 백신사업부 매출에서 Prevenar 13이 차지하는 비중이 90%를 상회하며 절대적 비중을 차지.
• Merck는 HPV(Human Papilomavirus, 인유두종바이러스)바이러스 예방 백신 Gardasil/Gardasil 9을 보유.
HPV바이러스는 성인 감염률이 70%에 육박할 정도로 높은 감염률을 보이며 꾸준히 확산되고 있어 Gardasil 접종률도 비례적으로 높아지고 있음.

글로벌 대표 기업의 감염증 백신 사업은 안정적 CashCow 사업
• Merck는 Gardasil(4가 백신, 6/11/16/18형)출시 이후 커버하는 HPV바이러스 유형을 9개로 확대한 Gardasil 9(9가 백신)을 출시하며 매출액을 확대.
Gardasil 9은 2014년에 FDA로부터 처음 승인 받았으며 이후 2016년에는 美 국가접종 프로그램에 선정.
Gardasil 9는 Gardasil 4가 백신에 고위험군 바이러스 유형인 31/33/45/52/58형을 포함한 백신.
• Merck의 백신사업부 분기별 매출액은 1Q19 18.8억달러, 2Q19 20.3억달러, 3Q19 25.1억달러, 4Q19 19.2억달러, 1Q20 21.5억달러, 2Q20 14.1억달러.
블록버스터 백신 제품인 Gardasil도 출시 후 시간이 경과됨에 따라 성장세는 둔화되었지만 꾸준한 실적 시현.
Gardasil의 분기별 매출액 추이는 1Q19 8.3억달러, 2Q19 8.8억달러, 3Q19 13.2억달러, 4Q19 6.9억달러, 1Q20 10.9억달러, 2Q20 6.5억달러.
• Pfizer의 블록버스터 폐렴구균 백신인 프레베나(Prevenar) 매출액은 11.1억달러(-5% yoy)로 백신 사업부 매출의 대부분을 차지(매출비중 89.5%).
대표 백신품목인 프리베나의 최근 매출이 감소한 주요 원인은 경쟁 백신의 출현.

III. 백신 개발 및 생산
생백신 vs 사백신
• 약독화 생백신(Live attenuated vaccines)과 사백신(Inactivated vaccines)은 전통적인 백신 제조 방법으로 생백신은 질병을 일으키는 바이러스 및 세균을 약화 시켜 백신을 제조.
질병을 유발하는 원인 바이러스를 반복적으로 배양하는 방식으로 바이러스가 보유한 병원성을 약화시키는 방법.
• 약독화 생백신은 바이러스/세균이 살아 있기 때문에 체내 면역 반응을 일으키는데 효과적이라는 장점이 있으나 개별 환자의 면역력에 따라 약독화 백신도 독성 위험이 있음.
대표적인 생백신으로는 대상포진/수두/홍역/유행성이하선염/풍진/황열/결핵 등.
• 사백신은 바이러스의 병원성 인자를 화학약품 또는 X-ray조사를 통해 병원성을 사멸시킨(비활성화 시킨) 백신.
비활성화된 바이러스도 여전히 체내에서 면역반응을 유발.
병원성이 사멸되었기 때문에 돌연변이 발생 및 질병 유발 위험이 낮아 안전하다는 장점이 있으나 항원자극이 일시적이거나 약해 여러 번 접종해야 하는 단점이 존재.
대표적인 사백신으로는 폐렴구균/A형간염/B형간염/백일해/파상풍 등.

2세대 백신: 분획화 백신
• 1세대 생백신/사백신 이후 좀더 효과적으로 면역 반응을 유도하면서 부작용을 낮추기 위한 백신 개발이 이루어 짐.
분획화 백신(Fractional vaccine)은 병원체의 조각(fraction)을 이용하는데 분획 요소에 따라 단백질/다당류/아단위/독소 백신 등으로 구분.
• 2세대 백신으로는 항원 추출 백신(아단위백신, Subunit Vaccines), 톡소이드(Toxoid Vaccines), 결합백신 등이 있음.
항원 추출 백신은 병원체가 보유한 단백질 중 면역 반응과 직접적으로 관련이 있는 항원 단백질만 분리/제조하여 접종 후 부작용이 적다는 장점이 있으나 일반 생백신/사백신과 비교해 제조 비용이 높음.
• 단백/다당 결합백신(Conjugate vaccines): 병원체의 단백질 조각으로 제조(Protein conjugated vaccine, PCV).
다당류 백신(Polysaccharide vaccine)은 면역 유도 효과가 약하기 때문에 보통 단백질에 다당류 백신을 혼합해 면역 효과를 높여서 사용.
• 톡소이드 백신은 병원체가 분비하는 독소에 타겟한 백신.
병원체가 유발하는 독소에 열 또는 화학 처리를 하여 질병 요인을 비활성화 시키면서 면역 반응을 유도하는 방식으로 디프테리아, 파상풍 백신에 많이 적용.

3세대 백신: 유전공학을 활용한 백신 개발
• 최근에는 유전 공학을 활용한 백신 개발이 주를 이루고 있음.
세포의 기본 정보를 담고 있는 유전물질(DNA, RNA)를 통해 보다 안전하고 효과적인 면역 효과를 유발하기 위한 노력.
유전자 재조합 백신(Recombinant vaccine), DNA/RNA 백신, 재조합 바이러스 벡터 백신 등이 여기에 속함.
• DNA백신은 병원체 바이러스의 DNA 일부를 인체에 주입해서 면역 반응을 유도하는 방식.
백신 개발의 가장 어려운 점은 독성인데 DNA 백신은 독성 이슈에서 큰 장점을 보유.
• 재조합 백신은 유전자 재조합 기술을 이용.
제조 하고 싶은 단백질 유전자를 벡터에 삽입해서 원하는 항원 단백질을 생산.
유전자 재조합 기술을 통해 원하는 치료 단백질의 대량생산이 가능해짐.
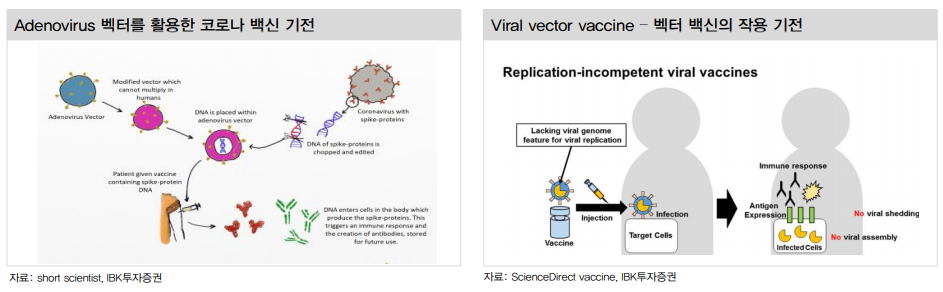
• 바이러스 벡터 백신(Viral vector vaccine)은 면역을 유발하는 바이러스를 체내 전달하기 위해 독성이 없는 바이러스 운반체를 이용.
안전한 벡터에 유용한 유전자를 심어 투약하여 체내 항체 형성을 유도.

백신 개발 타입별 시장 규모 및 전망
• 생백신 사백신 중심의 1세대에서 시작된 백신 산업은 2세대/3세대 백신이 공존하는 형태로 진화 발전.
아단위 및 결합 백신이 약 17억 달 러 규모의 가장 큰 시장을 형성하며 CAGR 10% 성장세를 이어가고 있음.
아단위 및 결합 백신에 이어 전통 방식인 약독화 백신(Live attenuated vaccines)과 사백신(Inactivated vaccines)이 뒤를 잇고 있음.
• 2세대 백신도 시장에 안착해서 연간 10%의 시장 평균 성장세를 보여주고 있음.
• 차세대 백신(3세대) 개발 및 투자도 활발하게 진행되고 있으며 본격적인 상용화는 코로나 백신을 시작으로 2021년부터 본격적으로 시장을 형성할 것으로 전망.

IV. 글로벌 코로나 백신 임상


Moderna – mRNA-1273 상용화 가능성 가장 높은 백신
• 임상 3상은 美 국립보건원(NIH) 산하의 국립 알레르기 및 전염병 연구기관(NIAID, National Institute of Allergy and Infectious Diseases)과 공동으로 진행.
임상 대상 환자는 총 3만명으로 18세 이상 성인이 대상.
• 임상 3상 시작일은 2020년 7월 27일이며 임상 완료 및 전체 데이터의 수집/분석이 완료되는 예상일은 2022년 10월 27일.
mRNA-1273은 백신 2회차 투약 이후 코로나 바이러스에 대한 면역효과가 2년 이상 지속되는 것을 타겟.

• 임상 3상 완료를 위한 전체 데이터는 2022년 10월경에 나올 것으로 예상되지만 중화항체 형성 및 면역반응 등 중요한 지표가 확인되는데로 긴급 승인을 통해 시장에 백신이 공급될 것으로 예상됨.
mRNA-1273의 임상 1/2상 대상환자수는 45명으로 2회차 백신을 투여한 41명에게서 중화항체가 형성된 것으로 확인.
• 임상 3상은 50대50으로 실험군과 대조군을 나눠 실험군에 백신을 투약하고 대조군에 플라시보를 투여하는 방식으로 진행.
투약방식은 근육주사(IM, Itramuscular)로 100ug 용량 백신이 임상 1일차와 29일차에 각각 1회씩 총 2회가 투여.
대조군에는 플라시보(0.9% 생리식염수)가 동일한 근육주사 방식으로 1일차와 29일차에 실험군과 같은 방식으로 총 2회 투약.
• Moderna는 백신 개발 이후 생산공급을 위해 스위스 제약사 Lonza와 파트너십 계약을 체결.
Lonza는 현재 美 뉴햄프셔 포츠머스 지역에 mRNA-1273 백신 생산라인 투자를 진행하고 있는 것으로 파악됨.
Moderna의 mRNA-1273이 올해 말에 긴급 승인이 나올 경우를 대비해 12월 전까지 생산시설 구축을 완료한다는 계획.

AstraZeneca – AZD1222 임상 2/3상 진입
• AstraZeneca의 AZD1222 코로나백신은 영국 Oxford University의 백신연구소와 함께 아데노바이러스 재조합 단백질로 개발중.
올해 4월 영국에서 성인환자 1,090명을 대상으로 임상 1/2상을 진행했으며 5월부터는 10,260명 환자를 대상으로 임상 2/3상을 시작.
• AstraZeneca는 7월 20일에 The Lancet에 임상 1/2상 결과를 기재.
임상 1/2상 결과 AZD1222가 투약된 코로나19 감염 환자 전원에게서 중화항체(Neutralizing antibody)가 형성되었으며 항체 지속기간도 충족한 것으로 발표.

• 부작용(Adverse reactions) 보고사례를 보면 중환자(Hospitalisation)급에서는 접종 이후 환자가 느끼는 부작용은 거의 없었으며 경미한 부작용은 대부분 증상이 경미한 환자(Mild to Moderate)군에서 나타났음.
확인된 부작용은 통증, 피부압통, 고열반응 등으로 다른 백신 접종시에도 일반적으로 나타나는 신체 반응이며 심각한 부작용은 보고되지 않은 것으로 발표.
백신접종은 특정 바이러스 및 병원체에 대한 체내 면역반응을 유도하는 방식이라 일반적으로 균을 사멸한 사백신이나 희석시킨 생백신 모두 면역유도 반응이 발생되는 과정에서 몸에 열이나거나 피부압통 등의 증상을 일정부분 동반하는 경우가 많음.
• AZD1222의 UK 임상 2/3상은 코로나19 바이러스에 대한 약물의 안전성, 효능, 면역원성에 대해 평가.
대상 환자수는 10,260명으로 올해 5월 28일 임상이 시작.
대상 환자군은 8개의 그룹으로 나누어서 진행.
그룹1과 그룹7은 56~69세 환자군이며 그룹2와 그룹8은 70세 이상의 고령환자군.
그룹3은 5~12세, 그룹4와 그룹6은 18세 이상, 그룹5는 18~55세.
코로나19 감염 증상의 정도가 연령별로 다르게 나타나는 점을 고려해서 연령별로 그룹핑해서 임상을 진행하는 것으로 파악됨.

• 백신 개발과 함께 선행해서 이루어져야 할 부분이 백신 생산공급 부분.
백신 임상이 긴급임상으로 승인을 받는 경우 공급 초기에는 전세계 인구를 대상으로 한 백신 수요를 단기간에 충족시키기 어려울 것으로 예상됨.
AstraZeneca는 백신 개발 이후 원활한 공급을 위해 인도의 Serum Institute of India와 백신 공급계약을 체결.
참고로 Serum Institute는 1966년에 설립되어 대량 백신 생산시설을 구축하고 저가에 백신을 전세계에 공급하면서 성장한 기업.

BNT162 – mRNA 백신 신속허가로 임상 3상 진입
• Pfizer와 독일 BioNTech의 코로나19백신은 재조합 mRNA백신으로 개발중.
BioNTech의 mRNA기술 플랫폼으로 개발된 표적항원 조합을 지닌 3종의 백신 후보물질에 대해 임상을 진행.
파이프라인 BNTb1과 BNTb2는 美 FDA로부터 신속허가 품목으로 지정되어 목표 결과값을 도출하면 올해 말에 승인을 이끌어 낼 수 있을 것으로 기대.
Pfizer/BioNTech은 독일에서 60명 대상으로 진행된 초기 임상에서 백신 접종 환자들에서 대부분 중화항체가 형성되었고 높은 수준의 T세포 반응을 이끌었다고 발표.
• Pfizer와 BioNtech에서 진행중인 코로나19 백신 BNT162의 임상 2/3상은 3만2천명 환자를 대상으로 진행.
BNT162의 연령별 접종 대상군은 3그룹으로 나뉨.
첫번째 그룹은 18~55세 일반 성인군, 두번째 그룹은 65~85세의 고령군 그리고 세번째 그룹은 18~85세의 전연령군.
용량(dose)에 따라 임상군도 나뉘는데 1~3 dose로 투약군을 분류해서 용량별 안정성과 효능을 확인할 계획.
대조군은 Placebo(위약군)로 동일한 조건에서 각 그룹별로 진행.
임상 시작일은 4월 29일이며 임상에 관한 전체 데이터 수집/분석이 종료되는 시점은 2021년 6월 28일.
백신접종 이후 장기 추적기간까지 마무리 되는 시점은 2023년 1월 23일.
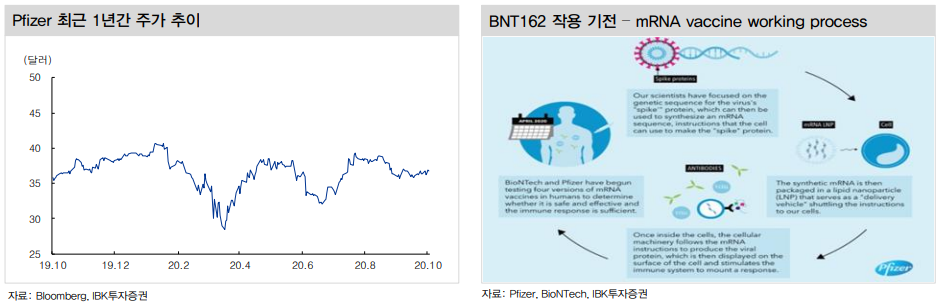
• BNT162 mRNA백신은 실제 바이러스 보다는 바이러스 표면의 Spike Protein(돌기단백질)을 타겟.
Spike Protein은 전자현미경으로 확인 가능한 바이러스 외피에서 표면으로 돌출된 단백질로 바이러스가 체내 침입해서 숙주세포의 수용체와 결합할 때 기능을 하는 단백질.
• 백신으로 개발된 합성 mRNA는 지질나노입자(LNP) 제형안에 넣어 약물을 전달.
체내에 투입된 mRNA는 세포에 도달해 유전코드(genetic sequence)에 따라 세포에 지시(instructions)를 내림.
세포는 mRNA 지시에 따라 세포 표면에 Viral Protein(바이러스성 단백질)을 분비하고 결과적으로 면역시스템을 자극해 적절한 자기면역 기능을 활성화.
백신은 20~30일 간격으로 2회 투약되어 항체가 형성되는 것을 목표.

Novavax – 재조합 단백질 백신후보물질(Matrix-M) 3상 진입
• 美 바이오텍 Novavax의 NVX-CoV2373는 Covid-19 Spike 단백질을 재조합 생산(Protein Subunit Recombinant SARS CoV-2)하여 곤충 세포에서 발현시킨 후 나노입자로 제조.
NVX-CoV2373는 Novavax의 면역증강제 Matrix-M을 이용해 항체 형성 능력을 높인 백신.
• Novavax는 최근 2상을 마무리하고 영국에서 자원자 1만명을 대상으로 백신 후보물질 임상 3상을 개시.
10월에는 미국에서 3만명 대상으로 별도의 임상 3상을 진행한다는 계획.
Novavax는 최근 SK바이오사이언스와 백신 후보 파이프라인 NVX-CoV2373 생산 CDMO계약을 8월 13일경에 체결.

• NVX-CoV2373 임상 1상은 건강한 환자 131명을 대상으로 면역증강제 Matrix-M adjuvant 투여군과 비투여군으로 나누어서 호주에서 임상을 진행.
시험 연령군은 18세에서 59세 건강한 성인.
임상 2상은 18~84세의 1,500명을 대상으로 호주와 미국에서 진행.
1상 발표 결과에 따르면 131명 실험군 모두 중화항체가 형성된 것을 확인하였으며 항체 농도 또한 Covid-19 감염 후 회복 환자에서 확인 된 것 보다 유의미하게 높은 것으로 발표.
Novavax 기업 개요
• Novavax는 1987년에 설립된 미국의 대표 백신 개발 업체로 Maryland 바이오 클러스터내 위치.
현재 美 나스닥 시장에 상장되어 거래되고 있으며 최근 시가총액은 68억달러 규모.
• Novavax의 주가는 올해 1월 $8 수준에서 코로나 감염증 확산에 따른 동사의 백신 개발 역량이 부각되며 8월달에 $170 까지 상승하였으며 현재 주가는 $110 내외에서 움직이고 있음.
• 2013년 면역증강 플랫폼 기술 Matrix-M adjuvant를 스웨덴 Isconova AB로부터 확보하고 백신 전문업체로 성장.
2015년에는 빌&멜린다 게이츠 재단으로부터 8,900만달러 자금 지원을 받음.
현재 Mtrix-M adjuvant 플랫폼을 활용한 5개의 백신 임상을 진행중에 있음.
V. 코로나 백신 생산(CMO)
백신 ColdChain 운송 – 다른 의약품 대비 운송에 시간과 비용 소요
• 백신은 생산에서 최종 소비자에게 접종되기까지 적정 보관 온도를 유지하는 것이 중요.
유통상에 적정 보관 온도를 유지하기 위해 ColdChain 유통망을 필요로함.
백신은 상온에서 유통이 가능한 의약품에 비교해 공급에 시간과 비용이 더 소요되는 특징이 있어.
• 생물학제제(백신)는 일반적으로 전체 운송 구간에서 2~8℃(평균 5℃)를 유지.
약독화 백신은 태양광에 노출되면 백신 역가가 떨어질 수 있으므로 유의해야.
백신 제조방법 및 작용 기전에 따라 보관온도 및 방법에 차이가 있어.
• 또한 생물학제제등 출하증명서를 작성해 전체 유통 단계를 관리.

SK바이오사이언스 – 본격적인 백신 공급단계에서 CMO역할 부각될 것
• SK바이오사이언스는 7월 21일에 성남판교에 위치한 SK바이오사이언스 연구센터에서 AstraZeneca와 Oxford대학 제너연구소에서 공동개발중인 코로나 백신 생산에 대한 협력의향서(LOI) 체결.
SK바이오사이언스는 안동 L House 백신센터를 활용해 AstraZeneca의 AZD1222 백신에 대한 CMO생산을 담당한다는 계획.
아직 AZD1222의 품목 승인이 나오지 않은 상황이라서 구체적인 생산규모 및 공급단가는 향후 양자간 협의로 결정될 것으로 예상됨.
• SK바이오사이언스는 2018년 5월2일 SK케미칼로부터 물적분할되어 설립된 바이오의약품(백신의약품 전문개발)업체.
현재 SK바이오사이언스의 지분 98.04%를 SK케미칼이 보유.
SK바이오사이언스는 SK케미칼이 1987년 생명과학연구소를 설립하고 이후 중소형 제약사를 인수하며 제약사업에 본격적으로 진출.
이후 백신사업을 중심으로 회사 역량을 집중하며 백신 시장에 안착한 기업.

• SK바이오사이언스는 2012년 경북 안동시에 자리한 경북바이오산업단지 내 첨단 백신공장 L House를 완공.
이후 생산설비 투자를 순차적으로 진행하며 생산Capa는 2019년 기준으로 연간 1억3,888만dose까지 증가.
2019년 기준 실제 생산량은 600만dose에 미치지 못하는 상황.
안동 L House 백신센터의 여유 생산Capa는 기존에 생산하는 대표 백신의약품의 생산확대 및 코로나19 백신 상용화 이후 생산물량 대응에 충분히 여유 있는 상황.
• 해외 파트너사와 백신 공동 개발 및 생산 협력을 해왔으며 CDMO사업도 전략적으로 확대.
2019년 기준으로 전체 매출에서 해외 매출이 차지하는 비중은 23.3%.
향후 AstraZeneca가 코로나19 백신 상용화에 성공하고 SK바이오사이언스가 전략적 파트너사로 생산을 담당하게 되면 해외 매출 비중은 급격히 커질 수 있을 것으로 예상됨.

• SK바이오사이언스의 2019년 매출액은 1,832억원으로 백신의약품 매출액이 80% 이상 차지.
동기간 손익은 영업이익 220억원, 순이익 141억원으로 양호한 실적.
재무현황(1Q20)은 총자산 3,924억원에 총자본 2,176억원.
SK바이오사이언스의 매출액은 2018년 881억원에서 2019년 1,832억원으로 큰 폭으로 증가.
올해에도 백신사업을 중심으로 사업 성장세는 이어질 것으로 보며 코로나19 백신 CMO사업이 새로운 도약의 기회가 될 수 있을 것으로 기대.
• SK바이오사이언스는 IPO상장을 위해 최근 NH투자증권을 대표주관사로 그리고 한국투자증권을 공동주관사로 선정.
실적 기반으로도 상장을 위한 조건은 충분히 갖춘 것으로 파악됨.
핵심 사업인 백신개발/제조 사업과 CDMO사업 그리고 코로나백신 생산을 통한 성장 가능성을 감안한 IPO 예상 시가총액은 3조원 내외.
같은 SK그룹사의 SK바이오팜의 상장사례를 참고할 필요가 있음.
• 美 바이오텍 Novavax와 백신 후보 파이프라인 NVX-CoV2373 생산 CDMO계약 8월 13일에 체결.
NVX-CoV2373는 Covid-19 Spike 단백질을 재조합 생산(Protein Subunit Recombinant SARS CoV-2)하여 곤충세포에서 발현시킨 후 나노입자로 제조.
NVX-CoV2373는 Novavax의 면역증강제 Matrix-M을 이용해 항체 형성 능력을 높인 백신.
• SK바이오사이언스는 Novavax의 협력기관인 CEPI(Coalition for Epidemic Preparedness Innovations)와 시설사용계약을 체결하고 안동 L 하우스 원액 생산시설 일부를 사용한다는 계획.
• Novavax는 최근 2상을 마무리하고 영국에서 자원자 1만명을 대상으로 백신 후보물질 임상 3상을 개시.
10월에는 미국에서 3만명 대상으로 별도의 임상 3상을 진행한다는 계획.

VI. 백신 시장 향후 전망
백신개발 시장은 소수의 승자가 시장 독식 가능성 높아
• 현재 코로나19 백신 개발로 진행중인 임상은 38건 그리고 비임상은 149건으로 총 187건으로 확인됨.
임상 진행건중에서 Moderna의 mRNA-1273, AstraZeneca의 AZD1222, Pfizer/BioNTech의 BNT162가 임상 3상을 진행 중이며 개발 및 상용화 가능성이 가장 높은 임상 파이프라인으로 시장의 주목을 받고 있음.
• 그리고 최근 Novavax는 NVX-CoV2373는 Covid-19 Spike 단백질 재조합 생산(Protein Subunit Recombinant SARS CoV-2) 방식으로 면역증강제 Matrix-M을 이용해 항체 형성 능력을 높인 백신을 임상 3상에 진입 시킴.
Novavax는 최근 2상을 마무리하고 영국에서 자원자 1만명을 대상으로 백신 후보물질 임상 3상을 개시.
10월에는 미국에서 3만명 대상으로 별도의 임상 3상을 진행한다는 계획.
언급된 4개의 백신 후보물질이 상용화 가능성이 가장 높을 것으로 예상됨.
긴급 승인은 소수의 백신 후보물질에만 부여될 것으로
• 임상 단계가 가장 빠르고 효능 및 안정성이 입증된 백신 후보물질부터 긴급 승인이 나올 것으로 예상.
백신 후보물질 2~3개가 승인 된 이후 자체 생산설비 및 CMO를 활용해 대량 생산이 시작되고 시장에 백신이 본격적으로 공급될 것.
• 승인된 백신의 대량생산이 진행된 이후에 진행되는 품목 승인은 기존의 정상 승인 프로세스로 회귀할 가능성이 높을 것으로 전망.
인체 투약 의약품은 중장기 추적 기간을 두고 효능과 안정성에 대한 확인이 이루어지면 품목 승인이 이루어지는데 현재 코로나19 감염증에 대한 대안이 없는 상황에서 이루어지는 긴급 승인 프로세스가 모든 임상에 적용되기는 어려울 것으로.
결과적으로 가장 먼저 승인을 받는 소수의 백신이 시장을 독식하는 형태가 될 것으로 예상됨
결국 코로나 사태를 종식 시키는 것은 치료제 보다는 백신
• 인류가 감염증을 본격적으로 이해하고 정복해 가기 시작한 것은 16세기 이후의 일.
중세시대 유럽에서는 감염증을 과학적 관점 보다는 종교적 관점에서 다뤄온 경우가 많았음.
최초의 백신은 우두를 이용한 천연두 예방이었으며 이후 콜레라, 디프테리아, 파상풍, 홍역, 인플라엔자 등의 감염증이 백신을 통해 관리.
백신 개발 이후 관련된 질병환자의 수는 매번 급격히 감소.
유아기때 부모에 의해 이루어지는 BCG, 각종 간염, 홍역, 수두, 파상풍, 디프테리아 등의 감염증에 대한 예방접종이 감염증을 정복하기 위해 인류가 개발했던 백신의 역사를 보여주고 있음.
• 감염증 정복의 역사는 백신의 역사.
코로나19 감염으로 인해 사망에 이르는 중등도 이상의 환자들의 생존율을 높이는 치료제도 물론 중요하지만 예방차원에서 진행되는 백신이 코로나 사태를 종식시키는 중요한 Key 역할을 할 것으로 예상됨.

결국 코로나 사태를 종식 시키는 것은 치료제 보다는 백신
• 감염증에 대한 치료제의 한계점은 명확.
美 FDA에서 긴급사용을 승인 받아 치료제로 처방되고 있는 Gilead Sciences의 렘데시비르(Remdesivir)가 코로나 감염 환자의 회복기간을 30% 이상 단축시키는 것으로 보고됨.
• 연구데이터를 보면 1,063명의 감염 환자를 대상으로 렘데시비르 투약한 결과 일반 치료를 받은 환자군은 퇴원까지 15일정도 소요되었으나 투약 환자군은 11일 만에 퇴원한 것으로 확인.
렘데시비르는 일부 중증 환자의 사망률을 낮추는 역할은 하고 있는 것으로 판단.
하지만 감염증의 확산을 막거나 궁극적으로 코로나 사태를 종식시키기에는 한계가 있다고 판단.
감염증 정복의 역사는 백신의 역사
• 기존의 글로벌 교역 시스템이 기존의 정상적인 상태로 복귀하기 위해서는 백신 개발이 필수적으로 선행되어야.
집단 면역 또는 인류 개체별로 감염과 항체형성이 자연적으로 진행되기에는 너무 오랜 시간이 걸림.
• 코로나19 감염으로 인해 사망에 이르는 중등도 이상의 환자들의 생존율을 높이는 치료제도 물론 중요하지만 예방차원에서 진행되는 백신개발은 건강한 일반인 전체에 영향을 미칠 수 있어 의미가 큼.
집단면역(Herd Immunity) – 늘어나는 항체 보유자, 줄어드는 감염 확산 가능성
• 인도 빈민가 주민 6,900여명을 대상으로 진행한 혈액검사 결과 주민 57%가 코로나19 바이러스에 대한 항체를 보유한 것으로 확인 (Tata Institue of Fundamental Research).
• 집단면역이 실현되는 면역형성 개체의 비중을 60% 내외를 기준으로 삼는데 인도 빈민가 사례가 이에 근접하는 수치.
• 비슷한 혈액 검사를 다른 도시 집단군에서 실시한 결과 대부분의 지역에서 항체 보유율이 20%를 하회.
• 미국 뉴욕시 및 기타 대도시에서 실시한 검사에서도 항체를 보유하고 있는 경우가 전체의 20~30% 수준으로 확인됨.

집단면역(Herd Immunity) – 스웨덴에서의 집단면역 기대와 실망
• 면역력을 갖춘 인구비율이 60%를 넘으면 감염증의 확산은 자연적으로 제어 될 것이라는 가정.
코로나19 감염증 확산 초기 봉쇄정책을 취한 대부분의 국가들과는 달리 스웨덴은 초기 감염증 진압에 통제 보다는 집단면역이 적합하다고 판단.
스웨덴은 항체 보유율이 60% 이상에 이르러 자연스럽게 집단면역이 실현되기를 기대.
• 스웨덴의 일일 사망자 수는 올해 3월말 부터 급증하기 시작해서 4월 중순에 Peak를 찍고 하락.
8월 이후로는 일일 사망자 수가 10명 이내로 감소.
스웨덴의 코로나 감염으로 인한 누적 사망자 수는 6,000명 수준을 달성한 후 크게 늘어나지 않고 있음.
스웨덴 정부가 기대했던 집단면역이 현재 시점에서 어느정도 실현 되고 있는 것으로 판단.

집단면역 vs 강력한 통제와 방역
• 강력한 사회적 거리두기를 시행하고 있는 한국은 감염증 확산에서 자유로울 수 있는 집단면역이 실현되는 시점이 더 길고 지루해 질 가능성이 높다고 판단.
• 인구 1,000만명 수준의 스웨덴의 초기 사망자수 급증, 하지만 이후 가파르게 하락하였으며 현재 안정기에 진입.
• 집단면역은 코로나19 감염 증상에 대해 취약한 계층의 희생이 요구되기 때문에 의도하지는 않았겠지만 Risky Game이 될 수 있음.
그렇기 때문에 백신 개발이 Risk를 최대한으로 줄이고 집단의 항체 보유율을 단기간에 급격하게 끌어 올릴 수 있는 방안이 될 수 있을 것으로 예상됨.
감염증 차단을 위한 봉쇄 정책을 실행하는 국가들이 특히 백신을 애타게 기다리는 이유이기도 함

고령층에 치명적인 Covid-19 vs 저연령대의 확진 대비 낮은 치명률
• 국내 연령별 확진자 및 사망자 현황을 보면 80세 이상의 확진자 사망률이 21.2%로 다른 연령군에 비해 월등히 높음.
연령별 사망 비중이 70세 이상에서 82.9%를 차지.
60 이상으로 확대해 보면 사망자 비중이 94%까지 높아짐.
높은 연령대에서의 사망률이 월등히 높음을 확인할 수 있음.
연령대별 확진자는 고르게 분포되어 있는데 반해 치명률은 극명한 차이를 보이고 있어.

• 국내 성별 확진자 비율은 여성이 54.1%로 남성보다 조금 높지만 반대로 사망률은 남성이 52.3%로 여성보다 조금 더 높게 나오고 있음.
• 국가별로 정확한 검진건수는 확인되지 않는 국가가 다수.
확인되는 국가들만 집계해 보면 건수 대비 확진률은 평균 3% 내외를 보여주고 있음.
특히 특정 이벤트 발생시 검진량이 증가하며 이에 비례해서 확진자가 증가하는 경우가 많음.

백신 개발 이후 누가 먼저 접종을 시작할까?
• 전세계가 안전성이 입증된 코로나 백신을 필요로 하고 있는 상황.
백신 개발이 성공적으로 완료되어 접종이 시작된다고 하더라도 초기에 공급할 수 있는 물량에는 한계가 있어.
국가별로 백신을 먼저 확보하기 위해 백신 개발업체들과 공급 계약을 체결하고 있으며 이에 관련된 뉴스가 연이어 발표되고 있는 상황.
• 의약품 산업은 단순히 시장 논리로만 수요와 공급 그리고 가격결정 요인을 설명하기 어려움.
의약품은 사람의 생명과 건강을 다루는 만큼 시장 논리를 기반으로 각 국가별 의료시스템과 정치적 논리가 복잡하게 얽혀 있기 때문.
전세계 백신 대기 수요 초기 공급은 한정적
• 단순히 시장논리로 백신 가격과 공급 지역이 결정되지는 않지만 현재의 시장 현황을 볼 때 백신 공급이 먼저 이루어질 지역은 예측해 볼 수 있을 것.
현재 백신을 개발중인 기업이 소재한 국가 그리고 백신개발 업체들과 초기 물량 공급 계약을 체결한 국가들에 먼저 백신이 공급될 것으로 예상.
미국, 유럽, 중국 등 선진국들이 여기에 해당하는 국가들.
그리고 해당 국가내에서도 백신 접종 우선순위를 정할 필요가 있을 것이며 코로나19 바이러스 병원체 접촉 가능성이 높은 의료진에게 가장 우선적으로 공급될 가능성이 높으며 이후 일반인을 대상으로 백신 접종이 시작될 것으로 예상 됨.
코로나 백신 생산에 참여하는 기업들 증가
• 백신 공급량은 현재 업체별 생산가능Capa를 고려하면 생산을 시작한 이후 월별로 빠르게 증가할 것을 전망.
백신 생산 업체들도 백신 개발 일정에 맞춰 생산설비 투자 및 생산기술 이전 작업을 진행중.
개발중인 백신마다 차이가 있지만 대부분 1~2회 접종으로 면역 형성 효과를 볼 수 있으며 재접종이 필요한 경우는 소수에 한정될 것으로 예상됨.
• 일부 과학자들이 우려하는 Covid-19 바이러스의 변종이 지속적으로 출현하더라도 첫 발생 시기와 비교할때는 감염증 확산이 제한적으로 나타날 것으로 예상됨.
현재 독감 바이러스 백신과 유사하게 변종에 대응하는 다가 백신을 연단위 주기로 접종을 할 가능성도 있음.
이럴 경우 Covid-19 백신 시장은 형성된 시장 규모를 유지해 나갈 수도 있음.
초기 공급 부족 이슈가 있겠지만 1년안에 해결 될 것으로
• 현재 백신 개발 업체 별로 공급을 위한 생산설비 투자 및 기존 바이오의약품 생산설비의 생산전환 작업이 발빠르게 진행중.
전세계 인류가 백신을 기다리는 상황에서 한번에 수요에 대응하는 공급이 이루어지기는 어렵겠지만 적어도 3개 이상의 백신이 승인이 난다고 가정했을때 공급이슈는 적어도 1년안에 해결될 것으로 예상됨.
확진자 증가와 함께 항체 보유자도 자연스럽게 증가 > 집단면역 형성
• 확진자가 증가함에 따라 자연스럽게 항체 보유자도 증가할 것으로 예상됨.
백신 개발과 더불어 자연 항체 보유자의 비중이 증가할 것으로 예상되며 항체 보유자가 증가하면서 자연스럽게 집단면역 효과도 나타날 것 예상됨.
코로나 백신 접종의 강제화?
• 백신이 개발 된 이후에 국가별로 백신 접종에 대한 차별화된 대응이 있을 것으로 예상됨.
대응 사례는 1)자율 접종, 2)국가가 관여하는 의무접종 형태로 구분해 볼 수 있음.
접종 비용 측면에서는 1)자율 결정, 2)접종비 일부 지원, 3)전액 지원 형태가 있을 수 있음.
백신은 감염성 측면에서 공공재 성격이 있어 다른 의약품과는 다르게 정부 개입 여지가 높은 것이 특징.
미국 뉴욕 브루클린에서 홍역 접종 강제 사례
• 작년 美 뉴욕에서 홍역이 유행. 홍역(measles)은 홍역 바이러스에 의해 발생되며 전염성이 강함.
주요 증상으로는 발열, 콧물, 홍반성반점, 결막염, 구진(피부발진)이 있음. 전염성이 강하기는 하지만 한번 감염되면 면역 효과가 평생동안 지속되서 재감염 위험은 거의 없는 것으로 알려짐.
• 2019년초 뉴욕에서 홍역이 확산되자 뉴욕주에서는 홍역 비상사태를 선택하고 백신 접종 명령을 발동.
접종을 강제하고 이를 거부할 경우 벌금 또는 학생의 경우 학교에서 등교를 거부하거나 또는 홈 스쿨링을 강제.
• 홍역 백신 접종을 거부한 인구수는 약 3만명 정도로 파악됨.
거부 이유는 종교적 또는 의학적 부작용에 대한 우려.
몇몇 임상 논문에 따르면 백신이 자폐증 출산율과 높은 상관관계가 있다는 의견이 있으며 학생의 학습 장애를 유발한다는 의견도 있음.
백신 접종율은 사회/정치/문화적 요소가 관여되서 전체 수요량을 예측하기 어려움
• 백신 접종에 저항이 심한 집단도 있음.
접종을 강제화 하기에는 비용을 떠나서 사회적 저항이 클 수 있음.
코로나19 감염증 관리와 백신은 정치인들의 대중 지지도와 밀접한 연관성이 있어 다양한 형태로 이용될 가능성 높아.
* 증권사 리포트 원문 link
consensus.hankyung.com/apps.analysis/analysis.downpdf?report_idx=572833
▶ Investory 인베스토리 텔레그램 채널 : https://t.me/investory123
▶ 증권사 신규 리포트 자동 알림 텔레그램 채널 : https://t.me/repostory123
- 증권사 신규 리포트를 자동으로 정리해서 텔레그램 메시지로 알려주는 채널
▶ 부동산 주요 뉴스 자동 알림 텔레그램 채널 : https://t.me/renewstory123
- 네이버 부동산 주요 뉴스를 자동으로 정리해서 텔레그램 메시지로 알려주는 채널



