* [블로그] [펩트론] CDMO 무지성 찌라시로 급락? (feat. 외인/기관은 매수) (2024.06.12)
https://blog.naver.com/redserpent/223477543342
[펩트론] CDMO 무지성 찌라시로 급락? (feat. 외인/기관은 매수)
오늘 펩트론은 장중 13% 이상 오르며, 역사적 신고가 달성을 앞두고 있었다. * 펩트론 일봉 차트 그런데 갑...
blog.naver.com
* [블로그] [펩트론] 일라이 릴리 골드만 삭스 컨콜 (feat. 복약 순응도 상승 필요) (2024.06.11)
https://blog.naver.com/redserpent/223475640729
[펩트론] 일라이 릴리 골드만 삭스 컨콜 (feat. 복약 순응도 상승 필요)
한국시간 오늘 새벽 5시(미국시간 6월 10일 오후 4시)에 일라이 릴리에서 골드만 삭스 글로벌 헬스케어 컨...
blog.naver.com
* 암젠,월1회 주사 비만약 게임체인저 급부상...‘한미약품·HK이노엔’ 영향은 (2024.06.05)
https://www.edaily.co.kr/news/read?newsId=01079126638918768&mediaCodeNo=257&OutLnkChk=Y
| 미국 암젠이 월1회 주사하는 비만 신약 후보물질 개발에 박차를 가하면서, 2029년을 전후로 시장 진입 가능성이 점쳐지고 있다. 현재 비만 주사제 임상 개발 단계에서 가장 앞선 한미약품(128940)과 HK이노엔(195940) 등에도 적잖은 영향을 줄 전망이다. 암젠은 특히 미국과 아시아 등 세계 각지에서 동시에 월1회 비만 주사 신약 후보물질의 임상을 진행하고 있다. 게임체인저 ‘마리타이드’ 2029년 글로벌 출시 전망 28일 제약바이오 업계에 따르면 가장 각광받는 주사형 비만 신약 후보물질로 암젠의 ‘마리데바트 카프라글루타이드’(마리타이드·프로젝트명 AMG133)가 떠오르고 있다. 마리타이드는 항체 단백질 접합체이며, ‘글루카곤유사펩타이드(GLP)-1’과 ‘위 억제 폴리펩타이드 수용체(GIPR)’에 동시에 작용한다. 암젠은 이미 지난 2월 마리타이드의 체중감량 효과가 최대 14.5%이며, 최장 150일까지 평균 11%대로 체중이 감량되는 탐색적인 효능을 확인했다는 연구 결과를 내놓기도 했다. 월1회 투약 용법의 비만 주사제에 대한 기대감이 커지는 이유다. 미국 클리니컬트라이얼에 따르면 이미 2023년 1월부터 당뇨병의 유무와 관계없이 과체중이거나 비만인 환자 592명을 대상으로 월1회 투약하는 용법을 적용한 마리타이드의 글로벌 임상 2상을 진행되고 있다. 해당 임상의 1차 종결 시점은 오는 10월로 예정됐으며, 연내 그 결과가 도출될 것이란 전망이 나온다. 비만약 개발 업계 한 관계자는 “이미 시장에 나온 비만약의 효능은 20% 중반이 최대치로 보고 있다. 약 먹었다고 체중이 30~40% 빠진다면 건강상의 문제를 일으킬 우려가 있다”며 “20% 수준의 체중감량 효능을 기본 조건으로 가져갈 때 투약편의성을 높이거나 근손실 등 부작용을 최소화하는 후보물질이 주목받게 될 것”이라고 말했다. 그는 이어 “노보 노디스크가 임상 3상 중인 경구용 비만약이나 마리타이드와 같은 물질이 게임체인저 후보군이다”며 “경구용 약이 투약이 편하긴 하지만, 성인이라면 매일 챙겨먹는 것보다 1달 이상 간격으로 맞는 주사제를 선호할 수도 있다. 경구 및 주사제 시장은 결국 동반 성장할 것”이라고 내다봤다. 경구용 비만약 시장과는 별개로 마리타이드의 등장은 해당 분야 주사제 시장의 지각변동을 일으킬 전망이다. 지난해 기준 비만약 시장은 약 11조~12조원으로 추산되고 있다. 덴마크 노보노디스크의 GLP-1 계열 약물인 ‘위고비’(성분명 세마글루타이드)와 ‘삭센다’(성분명 리라글루타이드)가 2023년 각각 매출 6조원과 3조원을 올리며 해당 시장을 주도했다. 위고비는 주1회, 삭센다는 매일 1회 투약하는 비만 주사제다. 28일 제약바이오 업계에서는 마리타이드의 임상개발이 순항할 경우 빠르면 2029년 미국 등 주요국 시장 진출에 성공할 것이란 전망이 나오고 있다. 무엇보다 마리타이드는 한국을 포함안 아시아 지역까지 동시 다발적으로 진출할 가능성도 있다. 이미 지난해 2월부터 마리타이드의 비만 환자 대상 국내 임상 2상이 개시됐다. 결국 현시점에서 국내사가 임상 중인 비만약 후보물질의 국내외 매출 확장성에 마리타이드가 주요 변수로 작용할 수 있는 셈이다.  국내 비만약 개발사 내세울 건 가격뿐? 국내사 중 임상3상 단계의 비만약 후보물질을 확보한 곳은 한미약품과 HK이노엔 등 2곳이다. 먼저 한미약품은 자체 발굴한 GLP-1 작용제 ‘에페글레나타이드’에 대해 지난 1월 국내 임상 3상 환자 등록을 개시했다. 회사 측은 해당 임상을 2026년 상반기까지 종료하고, 이르면 3년 내 국내에서 상용화하는 것을 목표로 하고 있다. 또 지난 5월 HK이노엔이 중국 사이윈드 바이오사이언스(사이윈드)로부터 ‘에크노글루타이드’의 국내 개발 및 상업화 권리를 기술이전받았다. 에크노글루타이드는 중국에서 당뇨 및 비만 관련 주1회 투약 용법으로 임상 3상에 진입한 상태다. HK이노엔 측은 에크노글루타이드에 대해 같은 적응증으로 국내 임상 3상을 추진한다는 계획이다. HK이노엔 관계자는 “에크노글루타이드의 당뇨 적응증은 중국에서 진행된 내용을 가교 임상으로 활용해 국내 시장 진입을 시도하면 된다. 하지만 비만 적응증은 식품의약품안전처와 중국 의약당국의 가이드라인이 달라 따로 진행해야 한다”며 “연내 비만 관련 우리 물질의 국내 3상 진입을 목표로 하고 있다”고 귀띔했다. 그는 이어 “에크노글루타이드의 상용화가 가시화 될 시점에서 암젠의 물질을 포함해 다양한 경쟁 약물이 존재할 것이다”며 “에크노글루타이드의 과거 임상에서 충분히 경쟁력있는 효능이 확인됐다. 여기에 가격 경쟁력을 더해 시장성을 높여가야 할 것으로 판단하고 있다”고 덧붙였다. 한편 △유한양행(000100)과 인벤티지랩(389470)의 ‘IVI-3021’ △프로젠의 ‘PG-102’ 등은 월1회 투약하는 비만 주사제로 개발되고 있지만, 전임상 단계이기 때문에 개발 성공을 논하기는 이른 시점이다. 김종윤 프로젠 대표는 “시장 선도 약물인 위고비나 일라이릴리의 ‘젭바운드’(성분명 티르제파타이드) 등이 연간 투약하려면 1만3000달러~1만5000달러의 비용이 든다”며 “투약편의성, 부작용 최소화 등도 주요한 경쟁 이슈이지만, 후발주자로서 가격 경쟁력을 확보하는 것이 중요한 축이 될 것”이라고 말했다. |
* [블로그] [펩트론] 글로벌 빅파마 6개사 중 4개사는 어디일까? (2024.05.30)
https://blog.naver.com/redserpent/223463016663
[펩트론] 글로벌 빅파마 6개사 중 4개사는 어디일까?
펩트론은 하루에 1번 맞거나 1주일에 1번 맞는 주사를 1개월에 1번이나 3개월에 1번 맞는 식으로 주사 횟수...
blog.naver.com
* [블로그] 펩트론 - 일라이릴리는 왜 1개월 제형 개발을 안할까? (2024.05.28)
https://m.blog.naver.com/investryu/223461503170
[펩트론] 일라이릴리는 왜 1개월 제형 개발을 안할까?
오늘 미래에셋에서 `24년 하반기 제약/바이오 섹터 전망 리포트가 나왔는데, 비만치료제 관련 내용이 ...
blog.naver.com
* 빅파마 4개사, 펩트론 약물전달 플랫폼에 러브콜..."공동개발 논의" (2024.05.24)
https://pharm.edaily.co.kr/news/read?newsId=01459606638892200&mediaCodeNo=257
| 펩타이드 기반 신약 개발사 펩트론(087010)이 확실한 ‘약물 지속형’ 플랫폼 기술로 글로벌 빅파마들로부터 러브콜을 받고 있다. 현재 논의 중인 비만치료제 기술이전 계약과 함께, 약물 지속 시간을 1개월 이상(기존 주 1회) 늘려주는 자체 개발 플랫폼 기술 ‘스마트데포’ 관련 빅딜이 성사될 지 관심이다. 23일 이데일리 취재 결과 펩트론은 독일 소재 B사와 벨기에, 일본, 스위스 소재 빅파마들과 스마트데포 기술 기반 신약 공동 개발을 논의 중이다. 이들 빅파마가 가진 기존 글로벌 대형 품목에 펩트론 플랫폼을 적용하거나, 새로 신약 후보물질을 개발하기 위한 논의 등을 이어가고 있는 것으로 알려졌다. 이들 기업 모두 글로벌 20위 안에 드는 대형 제약사다. 펩트론은 이들 기업과 약효가 최대 3개월까지 지속되는 제형 약물을 공동 개발할 가능성을 열어두고 있는 것으로 알려진다. 이는 현재 펩트론이 진행 중인 지속형 비만치료제 기술이전 계약과는 별개로 진행되는 건이다. 앞서 펩트론은 지난해 8월 글로벌 빅파마 A사와 스마트데포 기반 비만·당뇨 치료제 후보물질에 대한 물질이전계약(MTA)을 체결, 기술이전 계약을 진행하고 있다. 계약 체결 시, 두 회사는 월 1회 제형의 비만치료제 개발에 협업할 가능성이 높다. 시장에서는 펩트론이 특허로 보유하고 있는 월 1회 비만치료제 투약 기술이 충분히 실현 가능할 것으로 판단하고 있다. 펩트론 관계자는 “일부와는 비밀유지계약(CDA) 까지 진행된 상황이라 구체적인 물질에 대해선 밝힐 수 없는 상황”이라며 “약물 지속 시간을 늘려주는 당사 플랫폼 기술에 대한 빅파마들 관심이 계속 커지고 있는 것은 사실이다. 이러한 기회들이 추가 계약으로 이어지도록 노력하겠다”고 말했다. 펩트론은 오는 6월 미국 샌디에이고에서 열리는 바이오USA에 참가해 스마트데포 사업 확장을 위한 추가 기술이전 논의를 이어가겠다는 계획이다. 스마트데포는 반감기가 짧아 자주 주사하는 펩타이드(아미노산 화합물) 약물을 현재 주 1회 주사보다 투여 주기를 늘릴 수 있는 기술이다. 주로 수술용 생분해성 실로 쓰이는 PLGA를 구형(미세구체)으로 만들어 약물전달체로 사용한다. 이 생분해성 물질이 시간이 지나 분해되면서 이 물질에 섞여있던 약물이 방출되는 식이다. 이 미세구체의 원료와 함량에 따라 1개월 제형, 3개월 제형, 6개월 제형 등의 약을 자유롭게 만들어낼 수 있다. “루프원, 日 제약사와 CDA 체결” 펩트론은 스마트데포 기술을 적용한 첫 상용화 제품 ‘루프원’의 국내 품목허가도 기다리고 있다. 루프원은 1개월 지속형 전립선암 및 성조숙증 치료제다. 국내 판권은 LG화학(051910)이 확보한 상태며, 해외 진출을 위해 최근 일본의 한 대형 제약사와 CDA를 체결했다. 해당 제약사는 항암제를 주력 파이프라인으로 보유한 곳으로 알려졌다. 다만 기술수출은 통상 ‘비밀유지계약(CDA)→물질이전계약(MTA)→텀시트 수령→계약 체결’의 순서로 진행된다. CDA 체결은 기술이전 협의 초기 단계로, 실제 기술이전까지 이어질 가능성은 글로벌 평균 통계상 2% 미만이다. 펩트론은 지난달 식품의약품안전처로부터 루프원 생산을 위한 충북 오송 공장 실사를 받았다. 큰 이변이 없다면 하반기 초도 물량 생산, 품목허가 가능성이 높다. 펩트론은 루프원과 스마트데포의 추가 기술이전 논의를 위해 오는 6월 중국 상하이에서 열리는 ‘중국 의약품 전시회’(CPHI China)에 참가해 파트너링 미팅을 진행할 계획이다. 펩트론 관계자는 “지난달 일본 CPHI 에서 만난 여러 업체들과 중국에서도 다시 만나 추가 미팅을 진행할 예정이다. 구체적으로 파트너링 미팅을 통한 루프원 추가 기술이전, CDMO 업체들을 탐색하고 부스 전시를 통해 당사 스마트데포 기술을 소개, 홍보 하겠다”고 말했다. 루프원은 오리지널 류프로렐린 제제인 일본 다케다제약의 ‘루프린’의 복제약이다. 약물동력학을 세계 최초로, 생물학적 동등성을 국내 최초로 각각 확보한 제품이다. 루프린은 1989년 출시 후 30년이 넘도록 세계 시장 점유율 1위를 기록하고 있는 대표적인 블록버스터 의약품이다. |
* [펩트론] 코스닥 150 지수 편입 (feat. 패시브 자금 신규 유입?) (2024.05.25)
https://blog.naver.com/redserpent/223457790318
[펩트론] 코스닥 150 지수 편입 (feat. 패시브 자금 신규 유입?)
어제 장 마감 후 한국거래소에서 "KOSPI 200, KOSDAQ 150 및 KRX 300 구성종목 정기변...
blog.naver.com
* 생물 의약품 시대에 더 커진 제형 가치 - 유안타증권 (2024.05.23)
| 생물 의약품은 주사에 집중될 수 밖에 항체, 호르몬 등 생물 의약품은 아미노산들이 결합한 거대 분자로 높은 선택성을 통해 우수한 효과를 가지고 있다. 그러나 단백질로 되어 있어 경구로 투약 시 소화효소, 위산 등에 의해 아미노산으로 분해되어 약물의 특성을 잃게 되며, 분해가 되지 않았더라도 분자 크기가 커 체내로 흡수가 어렵다. 최근 리벨서스(Rybelsus, semalgutide) 등의 경구용 펩타이드 의약품이 승인되어 사용되고 있으나, 생체 이용률이 매우 낮다는 단점이 있다. 낮은 생체 이용률로 인해 일부 성분에서만 상업성이 있을 것으로 보이며, 개인간 흡수율의 편차도 클 것으로 보여, 저혈당 위험 등의 문제가 있는 인슐린 등에서는 적용하기 어려울 것으로 판단한다. 따라서 생물 의약품의 경우 주사 제형이 강제되고 있으며, 주사제의 경우 일부 피하 주사를 제외하면 전문가의 투약을 필요해, 복용 편의성이 저분자 화합물에 비해 낮은 문제점이 있다.  투약 간격 늘려주는 장기 지속형 주사제 투약 간격 길면 부담 없는 원내 투약 장기 지속형 주사제는 생분해성 고분자 등을 통해 투약 후에도 혈중으로 약물이 서서히 유리되도록 하는 방법으로 다량의 약물을 투약함에도 혈중 농도는 높이지 않으면서 투약 간격은 늘릴 수 있다. 투약 간격 연장으로 인한 투약 횟수는 IV 투약을 하더라도 병원 방문 횟수를 낮출 수 있으며, 3개월 또는 6개월 이상으로 투약 간격을 연장할 경우 투약 간격이 짧은 피하 주사와는 충분한 경쟁력이 있을 것으로 판단한다. 일반적으로 만성 질환자의 경우 3개월 또는 6개월 간격으로 병원 진료를 받는 경우가 많기 때문에 진료와 함께 투약이 가능하기 때문에 투약에 따른 병원 방문 부담은 급격히 낮아질 수 있다. 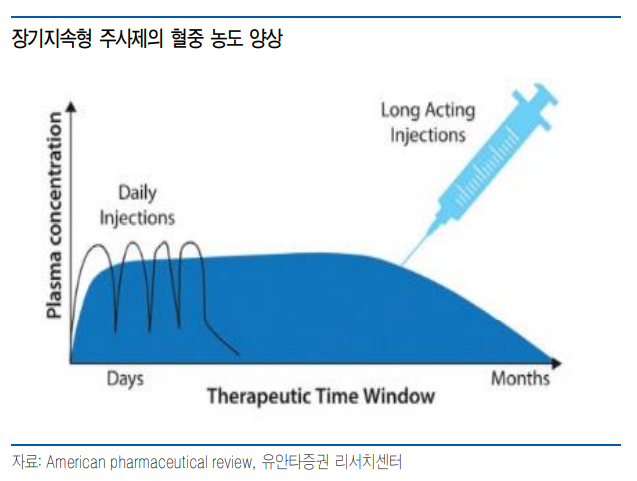 정신계 질환 등에서는 선호될 것 조현병(Schizophrenia)는 망상이나 환각 등의 증상을 나타내는 뇌신경계 질환으로 약물 치료가 필수적이다. 조현병 환자의 7~80%는 약물 치료에서 효과를 나타내는 것으로 알려져 있으나, 피해 망상, 자의적인 약물 중단 등으로 복약 순응도가 낮다. 조현병 환자의 약물 투약 중단 비율은 1년 내에 40%가 중단하며, 2년 내에 80%가 중단하는 것으로 알려져 있으며, 약물 중단시 재발 위험이 매우 높다. 낮은 복약 순응도로 인해 조현병 치료제 시장에서는 장기 지속형 주사제에 대한 선호도가 높다. 1개월마다 투약하는 인베가 서스티나(Invega sustenna, paliperidone)은 임상 시험에서 경구용 치료제에 비해 치료 실패 위험을 30% 낮췄으며, 2차 지표인 입원 및 구속 등까지의 시간도 450일 이상(경구제는 274일)으로 지연시켰다. J&J는 인베가 서스티나 이후 3개월 제형인 인베가 트린자(Invega trinza), 6개월 제형인 인베가 하피에라(Invega hafyera)까지 지속 기간이 연장된 제품을 출시하고 있으며, 오츠카도 1개월 제형인 아빌리파이 메인테나(Abilify maintena, aripiprazole)을 개발하면서 장기 지속형 주사제가 조현병 및 정신 질환 치료제 시장에서 선호될 것으로 보인다. 뇌신경계 질환으로 질환 시장을 확대 중인 애브비는 지난해 세레벨 테라퓨틱스(Cerevel therapeutics)를 인수했으며 4월 메드인셀(Medincell)과 19억 달러규모의 장기 지속형 주사제 개발 계약을 체결하면서 향후 뇌신경계 질환에서 장기 지속형 주사제 개발이 예상된다 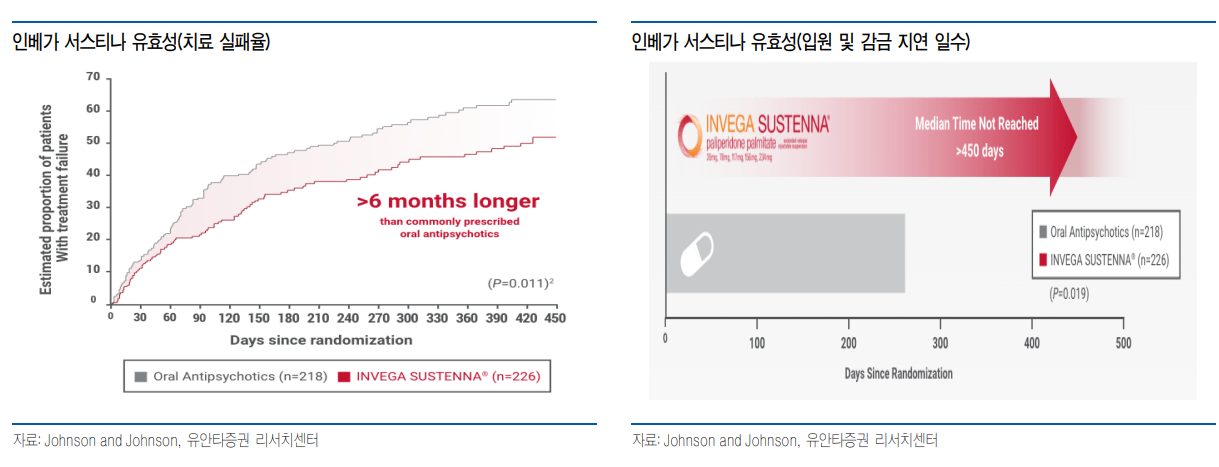  낮은 흡수율로도 상업화에 성공한 경구 펩타이드 펩타이드는 3~20개의 아미노산으로 이루어진 짧은 사슬 구조로 경구로 복용 시 소화기계에 존재하는 펩신, 트립신과 같은 소화 효소 및 위산에 의해 분해되어 약물의 특성을 잃게 된다. 또한 분해되지 않고 구조를 유지하더라도 큰 분자량으로 인해 체내로 흡수되기도 어렵다. 그러나 최근 경구용 펩타이드에 대한 관심이 높아지고 있으며 이는 리벨서스(Rybelsus, semglutide)를 통해 상업성을 확인했기 때문으로 판단한다. 리벨서스는 SNAC(Sodium N-(8-[2-hydroxybenzoyl]amino)caprylate)을 부형제로 사용해 안정화와 함께 위벽을 통한 약물 흡수를 증가시킴으로써 경구로 투여 가능한 semaglutide로 제2형 당뇨를 적응증으로 승인되었다. 리벨서스는 23년 26.5억 달러의 매출을 기록했으며, 현재 고용량(25mg, 50mg) 및 비만 임상 3상 진행 중으로 적응증 확대 등에 따라 매출 성장이 예상된다. 노보 노디스크는 후속 파이프라인으로 amycretin(GLP-1/amylin agonist)도 피하 주사 외에도 경구제를 개발 중으로 경구제는 복용 편의성과 용량 조절이 용이해 심화되고 있는 GLP-1 agonist 경쟁에서도 높은 시장 지배력을 유지할 수 있을 것으로 판단한다.  |
* [펩트론] GLP-1 : 670조원 시장? (feat. 키트루다 40조원) (2024.05.19)
https://blog.naver.com/redserpent/223451541887
[펩트론] GLP-1 : 670조원 시장? (feat. 키트루다 40조원)
당뇨/비만약으로 유명한 GLP-1의 시장규모는 앞으로 얼마나 될까? GLP-1은 당뇨/비만 뿐만 아니라 심...
blog.naver.com
* 리벨서스정은 다이어트약으로 사용할 수 없습니다. (오젬픽, 위고비 대체 불가능) (2023.05.28)
https://pharmit3000.tistory.com/1296
리벨서스정은 다이어트약으로 사용할 수 없습니다. (오젬픽, 위고비 대체 불가능)
리벨서스정 리벨서스정은 세마글루타이드(Semaglutide) 성분의 GLP-1 유사체로 당뇨병 치료제로 개발되었습니다. 같은 세마글루타이드(Semaglutide) 성분의 약은 주사제인 오젬픽, 위고비가 있습니다.
pharmit3000.tistory.com
* [블로그] 펩트론 3-2. 걱정마라 + 엄민용 리포트 (2024.05.16)
https://m.blog.naver.com/braveprepared/223448052083
펩트론 3-2. 걱정마라 + 엄민용 위원 리포트
갓민용은 IR자료 대충 옮겨적는 애널리스트들과는 달리 논문을 찾아보는 열정을 가지고 있다. 하지만, 분...
blog.naver.com
* 지속형 비만치료제 특허 그 자체만으로 - 신한투자증권 (2024.05.14)
https://bbs2.shinhansec.com/board/message/file.pdf.do?attachmentId=325503
| 지속형 비만치료제 L/0 여전히 유효해 긍정적 주가 전망 동사는 글로벌 비만치료제 회사들과 MTA(물질이전계약)을 체결했거나 또는 진행 중인 것이 2023년 확인. 1개월 지속형 비만치료제에 대한 기술이전이 임박했을 것으로 기대했으나 지연되며 최근 주가 하락. 기술이전 가능성에 대한 부분은 여전히 유효한 것으로 파악되며 현재도 최대한 빠른 시간 내 협의를 마무리하는 것을 목표하고 있다고 밝혀 주목 필요 주 1회에서 월 1회 또는 2-3개월 내 1회도 가능한 기술 펩트론은 짧은 반감기에 의해 체내 유효성이 떨어져 개발이 잘 되지 않던 시간을 잘 버텨온 펩타이드 전문 기업. 비만치료제가 새롭게 떠오르는 이 시점 기회를 잡을 수 있었던 가장 큰 요인이라고 생각. LG화학과 성조숙증/전립선암 치료제 루프원 판권계약 성공도 그 일환 국내 바이오텍들의 모든 공통사항이기도 하지만 목표로 하고있는 기술이전의 시점이나 계약 여부를 예측하기란 어려움. 우리는 그 사이 기업의 특허를 재조명하고 기술적 장벽이 잘 마련되어 있는지, 왜 빅파마가 이 기술을 써야만 하는지를 살펴보는 것이 중요 바이오는 처음부터 끝까지 기술력, 그리고 미국, 유럽 진출 가능성 이번 자료에서는 펩트론이 출원한 세마글루타이드 1개월 이상 지속형 비만치료제에 대한 특허에 대해 살펴보았는데 충분히 자체 노하우에 의한 원천기술임이 파악됨. 기술이전 기대감이 유효한 가장 큰 이유는 기술력 비만치료제는 수요 대비 공급이 부족한 상황, 만약 1개월 이상의 지속형 기술이 개발된다면 공급 문제를 해결할 기술인 것은 확실, 기술이전 여부도 중요하나 기술 자체의 가치가 중요한 시점. 저평가 판단 I. 비만치료제 그리고 펩타이드 전성기 비만치료제 L/O 기대감 여전히 유효 기존 매일 투약하거나 또는 주1회 투약하는 비만치료제들의 한계점을 극복해 1 개월 이상의 지속형 펩타이드 (비만치료제, 파킨슨병 치료제 등) 기술을 개발 중인 기업으로 최근 글로벌 빅파마들과 MTA(물질이전계약)을 맺으며 기술이전에 대한 기대감을 가지는 기업이다. 2023년부터 딜 성사에 대한 기대감이 있었다가 다소 지연되고 있으나 만약 국내 기업인 펩트론이 전세계에서 가장 주목하고 있 는 비만치료제의 1개월 이상의 지속형 제품을 계약체결할 경우 우리나라는 명실 상부한 ‘약물 전달 플랫폼’ 전문 국가로 도약하는 계기가 되지 않을까 싶다. 알테오젠이 전세계에서 가장 높은 매출액을 가진 약물이자 항암제인 키트루다를 머크와 출시하고, 펩트론이 노보노티스크, 일라이 릴리와 같은 전세계 1등 비만 치료제 빅파마와 손을 잡는 것이다. 전세계 1등 약물이자 항암제, 비만치료제를 모두 국내 바이오텍이 제형 개발을 해주는 것이니 섹터 자체에 신뢰도 회복에도 큰 기여를 할 수 있을 것이다. 그만큼 기대감이 높고 막중하다.  지금 펩타이드 시장은 완전히 새로운 국면을 맞이하고 있다. 정확하게 얘기하면 주목받아 본 적 없던 펩타이드 약물들이 전달기술의 발전으로 다시 거듭났다. 지난 20년 가까이 항체 약물이 바이오의약품의 대다수를 차지하던 과거를 벗어나 펩타이드가 다시 한번 더 주목받는 상황이다. 이번 펩트론 자료에서는 전달 기술의 한 가지로 펩타이드를 선택하고 있는 대표적인 시장으로 비만치료제 시장을 주목하고자 한다. 그리고 펩타이드를 어떻게 지속형으로 보낼 것인가를 같이 고민했다. 일라이 릴리와 노보노디스크의 주 1회 투약하는 지속형 비만치료제를 어 어떻게 1개월 이상 지속할 것인지 펩트론의 특허를 분석해 검토했다. 지난 1년 사이 항암제로만 주목받던 제약/바이오 산업은 이제 비만치료제 없이는 얘기할 수 없을 정도로 몸집이 커졌다. 바로 노보노디스크와 일라이 릴리의 주 1회 지속형 비만치료제 마운자로, 젭바운드(Zepbound, 성분명: tirzepatide) 덕분이다. 지난 11월 14일 릴리의 젭바운드가 FDA에 GLP-1/GIP 이중작용제로 비만 영역에서 최초 되었는데 BMI 30kg/m2 이상인 비만 성인 또는 BMI가 27kg/m2 이상인 과체중 및 의학적 문제가 있는 성인을 대상으로 처방한다.   젭바운드는 2.5mg/0.5mL의 용량을 시작으로 최대 15.0mg/0.5mL 용량까지 사전 충전된 1회 투여펜으로 총 6가지 용량(2.5mg, 5mg, 7.5mg, 10.0mg, 12.5mg, 15.0mg/0.5mL)으로 구성되어 있는 제품이다. 이렇게 6가지 용량으로 나눠진 이유는 저용량으로 시작해 2.5mg씩 증량하여 위장관 부작용을 최소화시켜 내약성을 키우기 위함이다. 2.5mg은 시작을 위한 용량이며 주1회 투약으로 4주마다 2.5mg씩 증량해 최대 15mg을 투약받을 수 있다. SURMOUNT-1 임상 3상에 따르면 매주 5mg을 72주간 투약했을 때 평균 16.1kg의 감량, 10mg을 72주간 투약했을 때 평균 22.2kg의 감량, 15mg을 72주 간 투약했을 때 평균 23.6kg을 감량하는 결과를 보였다. 가격은 1,059.87 달러로 1개월 처방에서 보험이 보장될 경우 최저 3달러 이상, 보험이 보장되지 않는 경우 최저 550 달러가 월마다 들어가게 되어 적은 금액은 아니나 이미 전세계 품절 사태를 일으키고 있다. GLP-1/GIP 이중 작용제 원리, 그리고 지속형이 가능한 이유 인간은 간에서 GLP-1을 식사에 대한 반응으로 자연적으로 생성할 수 있고 GLP-1은 혈당 수치를 조절하고, 음식물의 이동이 늦어지며 포만감을 올린다. 그러나 체내 DPP-4에 의해 빠르게 분해되어 지속성이 떨어지는 단점이 있는 상황이다. 릴리의 젭바운드는 DPP-4에 의한 GLP-1의 제거가 일어나지 못하게 하는 기술이 적용되어 체내 반감기가 5일 정도로 주 1회 투약이 가능한 약물이다.  인크레틴 효과(Incretin effect)는 포도당이 정맥으로 주입되는 것과 비교했을 때 경구 포도당 섭취에 의해 유발되는 인슐린의 분비가 높아지는 것을 뜻한다. 이 효과는 GLP-1과 GIP라는 두 가지 인크레틴 호르몬에 의해 매개된다. 장에서 생성되는 이 호르몬들은 영양소 섭취에 대한 반응의 결과라고 볼 수 있다.  GLP-1과 GIP가 체내에서 생성되는 과정을 우선 살펴보려면 프로글루카곤(proclucagon)을 알아야 한다. 프로글루카곤은 췌장의 알파 세포(α cell)와 소장의 K 세포(K-cell)및 L 세포(L-cell)에서 생성되는 160개의 잔기로 구성된 펩타 이드로 GLP-1과 GIP의 원료이다. GIP는 소장 상부의 K-세포에 의해 합성되며 GLP-1은 하부 창자의 L-세포의 의해 생성된다. 결론적으로 인크레틴들은 인슐린 분비, 글루카곤 억제, 베타 세포의 활성화, 식욕과 음식 섭취를 줄여 비만의 치료 효과를 이끌어 낸다. 젭바운드는 GLP-1의 기전을 이용하지만 우리 몸의 DPP-4와 밀접한 연관이 있다. DPP-4억제제는 GLP-1 수용체 작용제의 하나로 볼 수 있는데 시타글립틴, 삭사글립틴들이 일반적으로 사용된다. GLP-1 수용체 작용제들은 GLP-1 수용체를 활성화하여 GLP-1의 생리적 기능을 모방하지만 DPP-4 억제제는 DPP-4에 의한 GLP-1 분해를 방해하여 반감기를 증가시킨다. 젭바운드는 DPP-4에 의한 GLP-1 분해를 억제할 수 있는 구조로 이루어져 있어 기존 매일 투약하던 비만 치료제들과 달리 주 1회 투약이라는 차별점을 이뤘다.  젭바운드는 DPP-4의 분해를 피하는 방식을 통해 지속형으로 체내에서 반감기가 늘어나기도 하지만 혈장 단백질인 알부민(Albumin)과의 결합을 통해 체내 반감기가 더욱 늘어나는 2개의 기술이 들어가 있다. 위 tirzepatide의 구조를 살펴보면 2번과 13번 (빨간색 숫자)에 두 개의 암호화되지 않은 아미노산 잔기가 알부민과의 높은 친화력을 갖고 있다. 젭바운드는 혈장 단백질 중 하나인 알부민과 결합하여 반감기가 증가되는 구조를 갖고 있다. 젭바운드는 총 39개의 아미노산 잔기로 이루어져 있고 C20 위치에 연결된 지방 이산도 가지고 있다. 이 또한 간독성이나 반감기를 개선하는 역할을 해 준다. 바이오의약품 SC 개발을 위한 기존 방법, 고분자에 녹이기 그렇다면 최근 글로벌 빅파마들의 장기 지속형 피하주사 기술이전 현황은 어떨까? 꽤 주목할 만하다. 앞선 산업자료에서는 약물전달시스템 및 플랫폼 바이오에 특화된 기술들을 설명하고 ADC SC를 개발할 수 있을지 다루었다. 지금부터는 비만치료제 1개월 지속형 기술에 대해 자세히 다루었다. 먼저 장기 지속형 주사제 기업들 3곳을 살펴보자. 1) 최근 4월 17일 애브비(Abbvie)가 프랑스의 Medincell과 장기 지속형 주사제에 대한 기술이전을 19억 달러 규모로 체결했고, 총 6개 제품에 대해 공동 개발 및 판매를 할 예정으로 Medincell은 추후 로열티까지 수령 가능하다. BEPO라는 지속형(long-acting injectable cutting-edge technology platform)은 PEG/PLGA와 같은 생체고분자와 생체적합성(Biocompatible) 용매를 이용해 바이오의약품을 낮은 게이지(G)의 바늘로 피하주사(SC)할 수 있도록 하는 기술로 국내 펩트론과 굉장히 유사하다. 캐미칼의약품인 olanzapine이라는 조현병치료제에 대한 월 1회 장기지속형 피하주사를 최근 5월 9일 임상 3상 성공 발표했다.   2) 유사한 기술을 가진 기업이 2개 더 있다. 지난 1월 10일 암젠(Amgen)이 자가면역질환 블록버스터 테페자(Tepezza)의 피하주사 개발을 위해 Xeris와 7,500만 달러 규모 기술이전 계약을 하는 등 항체의약품 산업도 피하주사가 가능한 ‘전달 기술’을 통해 새 시대를 준비하고 있다. 할로자임과 이미 히알루로니다제를 이용한 SC를 개발 중인 암젠이 Xeris와 추가적으로 체결을 한 것은 20mg/kg까지 용량이 늘어나는 Tepezza가 IV일때도 60분이면 투약이 종료되는데 SC로 전환할 경우 그 용량이 더욱 높아지기 때문에 용량 부분에서 문제를 일으켜 Xeris를 선택했을 가능성이 있다. 아직 할로자임은 이유는 밝혀지지 않았다.  3) 또한 지난 2023년 10월 24일 일라이 릴리가 Electofi와 개당 1억 5천만 달러와 순매출에 따른 로열티를 한 자릿수 중반까지 받는 계약을 체결했고 최대 2개가 더 추가될 수 있도록 하였다. Hypercon이라고 하는 Electrofi의 미립자 현탁기술은 펩트론의 기술과 유사하지만 Electrofi는 항체와 같은 분자의 크기가 큰 단 백질 바이오의약품에 대한 개발을 위한 체결로 보인다.  II. 투자포인트 비만치료제로 새로운 시대 맞는 펩트론 주 1회 제형에서 월 1회 이상의 제형으로, 펩트론 기술 주목 앞서 젭바운드가 체내에서 어떻게 기존 매일 1회 주사로 투약하는 비만치료제 대비 높은 지속성을 유지할 수 있는지 알아봤다. 우리는 여기서 월 1회, 또는 분기 1회 투약만으로 비만치료제를 투약할 수 있는 기술에 대해서 알아보고자 한다. 그 이유는 국내에 있는 펩트론이 이 기술을 ‘특허’로 보유하고 있기 때문이다. 펩트론은 지난해부터 다국적 제약사와의 기술이전을 위한 MTA 계약 체결 및 실사 등을 진행했고 궁극적으로 월 1회 이상의 비만치료제 개발 및 협업을 기대하고 있는 만큼 면밀히 알아볼 필요가 있다. 펩트론이 가지고 있는 특허 중 노보노디스크의 오젬픽, 위고비의 원료명 세마글루타이드(semaglutide)의 1개월 이상 가능한 지속형 비만치료제의 특허를 검토해 보고자 한다. 실현 가능성이 있는지를 보고자 한다. 결론적으로는 충분한 원천기술력과 노하우를 가진 것으로 판단된다.  발명의 명칭은 ‘세마글루타이드 또는 이의 약학적으로 허용가능한 염을 포함하는 서방형 제제 조성물’ 이라는 제형 및 제조방법 특허로 출원번호 10-2022-0077146이다. 간단히 얘기하면 세마글루타이드(오젬픽, 위고비의 원료)를 분무건조 기술을 통해 월 1회 이상의 약물을 제조할 수 있는 제형 기술에 대해 특허로써 보호받고 있는 상태다. 상기 특허의 발명 내용 요약은 이렇다. ‘본 발명은 약물의 초기 과다 방출(initial burst)이 없고 장기간 지속 방출이 가능하면서도, 방출 지연(Lag phase)이 없고 생체이용률이 우한, 세마글루타이드(semaglutide) 또는 이의 약학적으로 허용가능한 염을 포함하는 서방형 미립구 및 이를 포함하는 서방형 제제 조성물에 관한 것이다.’로 특허에 대해 간단히 설명하고 있다.  쉽게 설명하면 PLGA라고 하는 생분해성 고분자(체내에서 녹는 물질)에 세마글루타이드 원료를 특정 조건에서 녹이고 분무건조기(Spray drying)에서 분무 및 건조시키는 것인데, 특징적인 것은 초기 방출과 후기 방출이 서로 나뉘어진 속도가 2가지인 PLGA + 세마글루타이드가 포함된 미세 입자(micro particle)를 만드는데 있다. 그리고 이 입자들을 피하로 주사할 수 있도록 하는 방법에 대해 특허로 설명하고 있다.   낮은 ‘저점도’에서 제조된 PLGA와 세마글루타이드는 초기 방출이 높지 않은 특징을 가지면서 초기 내약성을 유지하기 위한 수준의 방출이 가능하게 한다. 그리고 1개월 또는 그 이상 약효가 지속될 수 있는 수준으로 약물을 서서히 방출하는 ‘고점도’ PLGA로 제조된 세마글루타이드 미세 입자가 그 역할을 따로 해준다. 특허에 포함된 도면과 실험예, 비교예를 살펴보면 이렇다. PLGA 미립구를 제조하는데 있어 고유 점도가 0.14~0.24dL/g인 ‘저점도 PLGA’와 고유 점도가 0.32~0.44dL/g인 ‘고점도 PLGA’를 미립구(microparticle)를 주사할 수 있는 만큼의 크기인 15~2.5um 수준으로 분무건조 방법을 통해 제조한다. 그리고 저점도 PLGA와 고점도 PLGA에 대하여 1.8 ~2.2 비율로 섞어 지연방출이 없고 생체이용률이 우수한 지속형 비만치료제를 만드는 조성을 완성하는 것이다.  그리고 세마글루타이드는 전체 중량%에서 9%가 넘어갈 경우 초기 방출량이 높으며 중량%가 3 w%인 실험예 3에 대해 가장 많은 분석 결과를 보여준다. 여기서 1개월 이상의 지속 방출이 가능한 실험예 3의 방출 조건은 이렇다. 24시간 이내 5% 미만 방출, 2주 이내 30%, 5주 이내 60% 수준 방출을 요하고 있다. 도면 2는 실시예 3, 6과 비교예 1~4의 in vitro 초기 방출량의 결과를 보여주고 있다. 그리고 도면3에서는 S.D 랫드에서 세마글루타이드와 실시예3에서 피하주사 시 시간의존적인 포도당 저하 효과, 혈당수치를 측정한 결과를 보여주고 있다.  그리고 도면4에서는 S.D 랫드에서 세마글루타이드와 실시예3 주사 후 체중의 변화를 설명하고 있고, 도면5 에서는 실시예 3, 4, 6을 각 수컷 8주령 S.D 랫드에서 4mg/kg의 용량으로 동일하게 투여했을 때 비교를 보여준다. 그리고 도면6은 실시예 3, 4, 6에서 누적 방출량을 보여주고 있다. 함유량이 낮아야만 지속 방출 제형이 가능함을 볼 수 있다. 도면7에서는 실시예 3의 수컷 비글에서 실시예3을 4mg/kg으로 투여한 후 시간에 따른 혈중 약물 농도를 보여주고 있어 주목해서 보아야 한다. 그리고 도면8은 도면7과 같은 조건에서 세마글루타이드의 누적 방출량을 보여준다.  그리고 마지막으로 도면9는 리라글루타이드가 함유된 비교예13 및 14 제형에서 수컷 8주령 S.D 랫드를 대상으로 4mg/kg을 투여했지만 시간에 따른 혈중약물농도가 전혀 다른 결과를 보여줌으로 인해 이 제조방법 및 조성물에 대한 특허가 세마글루타이드에 특화된 것임을 강조한다. 이는 펩트론의 기술을 통해 유사한 약물들이 개발되기 어려움을 특정한다  실험예를 살펴보면 크게 4개 정도가 중요해 보인다. 실험예2는 세마글루타이드 체중감량에 대한 in vivo (동물 실험)의 결과인데 8주령 S.D 랫드 18마리 (각 6마리씩 3개군)으로 음성 대조군, 양성 대조군, 실시예3의 방법으로 만들어진 시험군을 각각 투여했다. 양성 대조군으로 세마글루타이드를 그냥 0.123mg/kg을 SC로 투약했고, 시험군은 펩트론의 특허방법으로 제조된 실시예3을 4mg/kg을 SC로 투약했다. 여기서 18시간 금식 시킨 후 2g/kg의 글루코스를 경구 투여 후 15분, 30분, 60분, 90분, 120분, 180분에 체혈 및 혈당을 측정했다. 그리고 1일, 7일, 16일, 28일에 OGTT(경구량부하검사)를 진행했다. 도면3을 보면 실시예 3은 시간 의존적 글루코스의 감소를 유도하고 그 기간이 21일까지 지속되는 것을 볼 수 있으나, 지속 형 기술이 적용되지 않은 양성대조군 세마글루타이드 0.123mg/kg 투여받은 랫드에서는 1일차는 혈당강하효과를 보였으나 7일에는 그 효과가 없었음을 볼 수 있었다. 그리고 실시예3은 10%의 체중감소 효과를 얻었으나 음성 대조군이나 양성 대조군은 모두 체중감소 효과가 없었음이 도면4에 나와있다.  실험예3도 중요한 결과를 나타내고 있다. 바로 약동학 프로파일인데 실험예 3, 4, 6을 각각 4mg/kg 투약한 뒤 시간에 따른 혈중농도곡선을 그려 곡선하면적(AUC) 를 구하고 상대적 생체이용률을 비교했다. (각각 주사 후 1, 3, 6, 24시간과 3, 5, 7, 9, 11, 14, 16, 18, 21, 24, 28, 31, 35일에 혈액을 0.5mL 체혈) 이 결과는 도면5 에 나와있으며 실시예6은 가장 높은 생체이용률을 보여주었으나 초기 방출량이 높음을 알 수 있어 지속형 비만치료제로 적용이 어려움을 보여주고 있다.   실험예4는 비글견에서 pk 프로파일을 관잘한 것인데 1, 3, 6, 24시간과 3, 5, 7, 9, 11, 14, 16, 18, 21, 23, 25, 28, 31, 35, 38, 42, 45, 49, 56, 63, 70일에 각각 체혈하여 생체이용률과 혈중농도곡선을 그려 곡선하면적(AUC)를 구했는데 AUC를 보면 랫드에 비해 비글에서 방출 지속 기간이 늘어나는 것을 볼 수 있고 28일에 94.61%까지 방출된 것을 확인할 수 있다. 여기서 중요한 점은 인간에서의 방출 지속성은 비글견보다 더욱 높을 것으로 기대하고 있다는 점이 굉장히 고무적이다. 우리는 펩트론에 대해 1개월 지속형 약물에 대해 기대하지만 2개월 또는 3개월 간격 투약을 하는 비만치료제에 대한 가능성도 충분히 볼 수 있다.  실험예5도 특허적인 측면, 기술적인 측면에서 펩트론만의 고유 원천기술이 필요함을 증명해주는 중요한 내용을 설명한다. 삭센다라는 제품명으로 잘 알려진 리라글루타이드는 매일 1회 투약하는 GLP-1 작용제인데, 리라글루타이드를 세마글루타이드에 적용한 조건으로 동일하게 제조하였을 때 도면9에서와 같이 거의 방출되지 않은 것을 보여준다. 단순히 PLGA를 통해 방출량을 조절하는 분무건조 방식을 사용한다고 하여 이 기술을 다른 기업이 제현하거나 적용할 수 없다 는 것을 뜻하는 것이다. 그 원료에 따라 용출 양상이 아예 다르기 때문이다. 결론적으로는 노보 노디스크의 오젬픽과 위고비의 원료인 세마글루타이드(semaglutide)나 삭센다의 원료인 리라글루타이드(liraglutide), 일라이 릴리의 마운자로나 위고비의 원료인 터제파타이드(tirgepatide) 모두 각각의 분무건조 조건이나 PLGA의 비율 등이 큰 차이를 나타내고 이는 펩트론의 고유의 기술적 노하우가 필요할 것으로 추측된다.  |
* 노보노디스크와 메타포社의 GLP-1 장기지속형 개발 계약, 펩트론에게 영향은? (2024.05.13)
https://m.blog.naver.com/investryu/223445438181
노보노디스크와 메타포社의 GLP-1 장기지속형 개발 계약, 펩트론에게 영향은?
요 몇주간 살살 오르더니, 장 시작 하자마자 오랜만에 하락VI를 시작으로 시원하게 조정을 줬다 ! 회사에...
blog.naver.com
* [펩트론] 암젠 1개월 제형과의 차이는? (2024.05.12)
https://blog.naver.com/redserpent/223443939284
[펩트론] 암젠 1개월 제형과의 차이는?
Episode.1 암젠 먹는 비만약 포기, 1개월 비만 주사제 집중 얼마전 암젠(Amgen)이 1분기 컨콜에서 1. 기...
blog.naver.com
* [펩트론] 암젠 먹는 비만약 포기, 1개월 비만 주사제 집중 (키움 허혜민 코멘트) (2024.05.03)
https://blog.naver.com/redserpent/223434853279
[펩트론] 암젠 먹는 비만약 포기, 1개월 비만 주사제 집중 (키움 허혜민 코멘트)
1. 암젠 먹는 비만약 포기, 1개월 비만 주사제 집중 2. 급해진 일라이 릴리와 노보 노디스크..... 3. 무르...
blog.naver.com
* 펩트론 : 일라이 릴리, 일관된 흐름과 강화된 톤 (2024.05.02)
https://m.blog.naver.com/vlvk1703/223434597021?referrerCode=1
펩트론 : 일라이 릴리, 일관된 흐름과 강화된 톤
- 지난 번 게시글을 통해 경쟁사 암젠의 1개월 제형 비만 치료제 AMG-133(마리타이드, 이하 AMG-133)...
blog.naver.com
* [펩트론] 일라이 릴리 힌트(?)에 대한 개인적인 해석 (2024.05.02)
https://blog.naver.com/redserpent/223434266438
[펩트론] 일라이 릴리 힌트(?)에 대한 개인적인 해석
일라이 릴리 2024 Q1 컨콜에서 펩트론에 대한 힌트(?)가 나왔다. * 일라이 릴리 2024 Q1 컨콜 내용 https...
blog.naver.com
* 펩트론 '루프원', 해외 진출 시동… "日 제약사와 CDA 진행중" (2024.05.02)
https://www.edaily.co.kr/news/read?newsId=01380886638884984&mediaCodeNo=257&OutLnkChk=Y
| 펩타이드 기반 신약 개발사 펩트론(087010)이 1개월 지속형 전립선암 및 성조숙증 치료제 ‘루프원’의 해외 시장 진출에 시동을 걸었다. 국내에서는 올해 하반기 초도 물량 생산과 품목허가가 유력하다. 1일 업계에 따르면 펩트론은 일본의 한 대형 제약사와 루프원에 대해 CDA(비밀유지계약) 체결을 진행하고 있다. 해당 제약사는 항암제를 주력 파이프라인으로 보유한 곳으로 알려졌다. 펩트론 관계자는 “지난 일본의약품박람회 ‘CPHI Japan’에서 루프원 도입에 관심을 표명한 중국과 일본 회사들이 있었다. 이 중 일본 회사와 현재 CDA 체결을 진행 중”이라고 밝혔다. 다만 CDA 체결은 기술이전 협의 초기 단계로 실제 기술이전까지 이어질 가능성은 글로벌 평균 통계상 2% 미만이다. 동시에 회사는 미국과 태국, 대만 시장 진출도 준비 중이다. 먼저 미국 진출을 위해 회사는 현재 1개월 지속형 제형을 3개월로 늘려 출시하겠다는 계획이다. 미국의 1개월 지속형 제형 시장 규모가 워낙 작아 시장성이 없다고 판단한 데 따른 것이다. 현재 글로벌 시장에서 3개월 제형 시장의 주요 플레이어로는 일본 다케다제약과 미국 애브비 등이 있다. 태국과 대만의 경우 웨이버(의무면제) 제도를 통해 국내 시판 자료만으로 현지 품목허가를 받을 가능성이 있다는 설명이다. 태국과 대만은 아시아 지역에서 주요 의약품 시장으로 꼽힌다. 펩트론은 지난달 식품의약품안전처로부터 루프원 생산을 위한 오송 공장 실사를 받았다. 큰 이변이 없다면 하반기 초도 물량 생산, 품목허가 가능성이 높다. 펩트론의 충남 오송 공장은 200억원을 투자해 2018년 12월 완공됐다. 펩트론의 핵심 자산으로, 임상 시료 및 상업 제품을 생산할 수 있는 의약품제조 및 품질관리기준(GMP) 공장이다. 국내뿐만 아니라 유럽 GMP도 충족했다. 최대 생산 가능량은 연간 100만 바이알이다. 루프원의 국내 판권은 LG화학(051910)이 확보한 상태다. LG화학은 루프원으로 국내 성조숙증 치료제 시장을 본격 공략한다는 전략이다. 펩트론은 LG화학과의 계약 등을 문제로 매출 전망치를 공개하지는 않았다. 다만 국내 성조숙증 시장이 1200억원 규모로 추정된다는 점을 고려하면, 점유율 10%만 달성해도 펩트론은 연간 100억원 이상 매출을 기대할 수 있다. 루프원은 오리지널 류프로렐린 제제인 일본 다케다제약의 ‘루프린’과 약물동력학(PK)을 세계 최초로, 생물학적 동등성(BE)을 국내 최초로 각각 확보한 제품이다. 루프린은 1989년 출시 후 30년이 넘도록 세계 시장 점유율 1위를 기록하고 있는 대표적인 블록버스터 의약품이다. 업계에서는 루프원이 국내외 1개월 지속형 전립선암 치료제 시장에 게임체인저가 될 수 있을 것으로 보고 있다. 루프원은 루프린 대비 약물의 입자 크기 및 주사 게이지를 줄여 품질과 투약 편의성을 혁신적으로 개선, 차별화된 경쟁력을 확보했다는 평가를 받고 있다. 연내 흑자전환 가능할까 펩트론은 2015년 기술특례 제도로 코스닥시장에 입성한 후 단 한 번도 흑자를 내지 못했다. 핵심 수익원인 기술수출 계약 성과가 부진했기 때문이다. 최근 3년 간 매출을 보면 2021년 66억원, 2022년 58억원, 지난해 33억원으로 감소세며, 연구개발 비용 등으로 매년 150억원 이상씩 영업손실이 발생하고 있다. 펩트론의 지난해 말 기준 현금성 자산(금융기관 예치금 포함)은 약 60억원 수준이다. 매년 지출 비용을 고려해볼 때 연내 기술수출 성과를 내거나 매출이 급증하지 않으면 자금조달이 필요한 상황이다. 이에 회사는 올해 1월 운영자금 마련을 위해 보유한 땅을 매각한다고 발표했다. 양도가격은 약 76억원이며, 지난달 매각 절차를 모두 마무리했다. 루프원은 펩트론의 ‘스마트데포’ 기술로 자체 생산하는 첫 상업화 제품이다. 스마트데포는 반감기가 짧아 자주 주사하는 펩타이드(아미노산 화합물) 약물을 주 1회 또는 6개월 1회 주사가 가능하도록 약효를 연장시키는 펩트론의 핵심 기술이다. 스마트데포는 초음파 분무건조를 이용해 약물을 저장하고 서서히 방출할 수 있는 작은 구슬방울로 대량생산이 가능하다는 장점이 있다. 약물이 들어 있는 생분해성 구슬방울이 혈액에서 서서히 방출되는 것으로 체내 일정한 약물농도를 유지하는 기전이다. 회사는 현재 글로벌 빅파마와 스마트데포 기반 신약 후보물질에 대한 기술이전 계약을 진행 중이다. 지난해 8월 물질이전계약(MTA)을 체결, 기술이전을 준비하고 있다고 밝혔다. 펩트론 관계자는 흑자전환 시기를 묻는 질문에 “현재 글로벌 제약사와 진행 중인 비만 치료제 기술이전이 된다면 당장 올해 흑자전환이 가능하겠지만, 딜이 지연될 경우 올해는 어려울 것 같다”고 밝혔다. |
* [펩트론] 일라이 릴리 2024 Q1 컨콜 자료 (스크립트 포함) (2024.05.01)
https://blog.naver.com/redserpent/223432629308
[펩트론] 일라이 릴리 2024 Q1 컨콜 자료 (스크립트 포함)
어제 밤에 일라이 릴리 2024 Q1 컨콜이 있었다. * 일라이 릴리 2024 Q1 Earnings Call https://investo...
blog.naver.com
* 리벨서스 뒤 잇는 먹는 GLP-1 제제, 치료 중단률이 문제 (2024.04.15)
http://www.monews.co.kr/news/articleView.html?idxno=331233
| 유일한 경구용 GLP-1 수용체 작용제(GLP-1 제제)인 노보노디스크의 리벨서스(성분명 세마글루타이드) 뒤를 잇는 신약들이 안전성 문제로 고초를 겪고 있다. 경구용 GLP-1 제제 후보물질인 일라이릴리의 올포글리프론과 화이자의 다누글리프론은 임상연구에서 2형 당뇨병(이하 당뇨병) 또는 비만 환자의 당화혈색소 및 체중 조절 측면에서 좋은 결과를 얻었지만 치료 중단율이 높게 보고됐다. 이런 가운데 다누글리프론은 높은 치료 중단율을 이유로 지난해 개발이 중단됐다. 이에 경구용 GLP-1 제제가 당뇨병 환자에게 효과적인 치료옵션이 될 수 있을지라도, 임상연구에서 보고된 높은 치료 중단율은 의료진의 처방을 주저하게 만드는 걸림돌로 작용할 것으로 보인다. 고대 안암병원 김남훈 교수(내분비내과)는 11~13일 그랜드 워커힐 서울에서 열린 대한내분비학회 국제학술대회(SICEM 2024)에서 'Oral GLP-1 receptor agonist'를 주제로 발표했다. 올로글리프론, 혈당·체중 유의하게 줄여…위장관계 이상반응은 '흠' 펩타이드 기반 약제인 리벨서스 이후 개발되는 경구용 GLP-1 제제는 비펩타이드 소분자 약물이다. 가시적이 성과를 내고 있는 약제는 올로글리프론이다. 올포글리프론은 화학적으로 합성된 비펩타이드 제제로, 반감기가 29~49시간이며 리벨서스와 달리 음식 및 물 섭취 제한 없이 1일 1회 복용 가능하다. 리벨서스는 공복상태에서 복용하고 이후 최소 30분 동안 아무것도 먹거나 마시지 않아야 환자에게 좋다는 점에서, 약제 간 차이가 있음을 알 수 있다. 올포글리프론은 원숭이 대상 연구에서 경구 섭취 시 생체이용률이 최대 67%로 조사됐다. 올포글리프론은 두 가지 임상2상을 통해 당뇨병 그리고 비만치료제로서 가능성을 입증했다. 첫 번째 이중맹검 무작위 다기관 임상2상은 메트포르민 치료 여부와 관계없이 식이요법과 운동을 하고 있는 당뇨병 성인 환자를 위약군과 둘라글루타이드군, 올포글리프론군(3, 12, 24, 36, 45mg) 등으로 분류해 올포글리프론의 효능과 안전성을 평가했다. 올포글리프론은 식사 시간 제한 없이 아침에 복용하도록 했다. 분석 결과, 26주째 평균 당화혈색소 감소율은 위약군 0.43%, 둘라글루타이드군 1.1%였고 올포글리프론군은 최대 2.1%로 조사됐다. 올포글리프론군과 위약군 간 당화혈색소 감소율 차이는 통계적으로 유의미했다. 등록 당시 대비 26주째 평균 체중도 올포글리프론군은 최대 10.1kg 줄었지만, 위약군은 2.2kg, 둘라글루타이드군은 3.9kg 감소에 그쳤다. 그러나 이상반응으로 인한 치료 중단율은 둘라글루타이드군이 4.0%였지만, 올포글리프론군은 이보다 높은 11.8~19.1%로 보고됐다. 특히 메스꺼움, 설사, 구토 등 위장관계 이상반응 발생률이 올포글리프론군에서 높았다(Lancet 2023;402(10400):472~483). 올포글리프론은 비만 환자 대상의 무작위 이중맹검 임상2상에서도 좋은 효능 결과를 얻었다. 연구에는 당뇨병 동반 여부와 관계없이 비만하거나 최소 한 가지 이상 체중 관련 동반질환이 있는 과체중 성인 환자가 모집됐다. 이들은 올포글리프론군(12, 24, 36, 45mg)과 위약군에 무작위 배정돼 36주 동안 치료받았다. 1차 목표점인 등록 당시 대비 치료 26주째 체중 감소율은 올포글리프론군이 8.6~12.6%였고 위약군은 2.0%에 불과했다. 2차 목표점인 36주째 체중 감소율은 올포글리프론군 9.4~14.7%, 위약군 2.3%로 조사됐다. 올포글리프론군은 사전에 정의한 모든 체중 관련 목표점 및 심장대사 평가요인이 개선됐다. 하지만 이 연구에서도 올포글리프론군의 안전성이 문제가 됐다. 가장 흔하게 보고된 이상반응은 위장관계 사건이었고, 특히 올포글리프론군에서 메스꺼움 발생률이 약 50%로 상당히 높게 보고됐다(N Engl J Med 2023;389(10):877~888). 다누글리프론, 효능 입증했지만…치료 중단율 50% 이상 "높은 치료 중단율은 진료현장에서 처방 막는 걸림돌 될 수 있어" 또 다른 비펩타이드 소분자 약물인 다누글리프론도 당뇨병과 비만 치료를 노리며 임상2상이 진행됐다. 다누글리프론은 효능 측면에서 좋은 결과를 얻었지만 결과적으로 안전성 문제에 발목이 잡혀 쓸쓸히 퇴장했다. 다누글리프론의 임상2a상에는 메트포르민 치료를 받고 있는 당뇨병 환자와 당뇨병이 없는 비만 환자가 모집됐다. 당뇨병 환자는 위약군 또는 다누글리프론군(80, 120, 200mg 1일 2회 복용)에, 당뇨병이 없는 비만 환자는 위약군 또는 다누글리프론군(200mg 1일 2회 복용)에 무작위 배정됐다. 12주째 효능을 평가한 결과, 등록 당시 대비 당화혈색소는 다누글리프론군이 1.04~1.57% 감소했고 위약군은 0.32% 감소에 그쳤다. 체중은 다누글리프론군이 1.93~5.38kg 줄었지만 위약군은 0.42kg 감소했다. 이 같은 두 군 간 차이는 통계적으로 유의미했다. 그러나 치료 관련 이상반응으로 인한 약물 중단율은 당뇨병 환자인 다누글리프론군에서 18.2~38.1%로 높았고, 비만 환자군에서는 무려 54.4%에 달했다(Diabetes Obes Metab 2023;25(10):2805~2814). 임상2b상 결과도 비슷했다. 임상2b상은 메트포르민 치료 여부와 관계없이 식이요법과 운동만으로 당화혈색소가 조절되지 않는 당뇨병 환자를 모집해 다누글리프론의 효능 및 안전성, 내약성을 평가했다. 16주째 분석 결과, 당화혈색소와 공복혈당은 다누글리프론군이 위약군보다 유의하게 조절됐다. 하지만 치료 기간이 16주로 짧았음에도 불구하고 치료 관련 이상반응으로 인한 약물 중단율은 다누글리프론군에서 최대 34%까지 높게 보고됐고, 위약군은 8%에 그쳤다(JAMA Netw Open 2023;6(5):e2314493). 결국 화이자는 지난해 12월 임상연구에서 확인된 다누글리프론군의 50%에 육박하는 높은 치료 중단율에 따라 다누글리프론의 개발을 중단하고 임상3상도 진행하지 않는다고 발표했다. 김남훈 교수는 "당뇨병 환자 치료 시 경구용 GLP-1 제제는 당화혈색소를 등록 당시보다 최대 2.1%, 체중을 최대 10kg까지 줄일 수 있다"면서도 "하지만 최대 용량에서 이상반응로 인한 치료 중단율은 임상2상에서 40%까지 보고됐다. 이는 실제 진료현장에서 경구용 GLP-1 제제 사용을 막는 허들로 작용한다"고 지적했다. 이어 "경구용 GLP-1 제제는 당화혈색소와 체중 조절 측면에서 피하주사 GLP-1 제제와 유사한 효능을 보인다. 그러나 복잡한 투약 일정과 높은 치료 중단율, 비용 등은 진료현장에서의 활용을 막는 걸림돌이 될 수 있다"며 "그럼에도 경구용 GLP-1 제제 개발은 당뇨병 관리의 중요한 이정표다. 국내에 도입될 경우 약값이 어떻게 정해질지 알 수 없으나, 당뇨병 환자에게 효과적인 추가 치료옵션으로 제공할 수 있을 것"이라고 덧붙였다. |
* [펩트론] 4, 5월 L/O 계약을 예상하며... (feat. 사건의 재구성) <내용 보완> (2024.04.07)
https://blog.naver.com/redserpent/223408467805
[펩트론] 4, 5월 L/O 계약을 예상하며... (feat. 사건의 재구성) <내용 보완>
< 최초로 작성한 글에서 아래 Episode 2의 채용공고 내용을 보완했다 > 펩트론은 현재 1주일에 1번 ...
blog.naver.com
* [펩트론] 노보 노디스크의 GLP-1 물질특허 만료를 앞두고... (2024.04.04)
https://blog.naver.com/redserpent/223405907128
[펩트론] 노보 노디스크의 GLP-1 물질특허 만료를 앞두고...
오늘 중국에서 노보 노디스크의 오젬픽 바이오시밀러가 개발되고 신약 승인 신청까지 이루어졌다는 기사가 ...
blog.naver.com
* 글로벌 헬스케어 처방전 4월호 - 미래에셋증권 (2024.04.01)
https://securities.miraeasset.com/bbs/maildownload/20240401103012613_3694
| 4. GLP-1 기반 경구용 비만 신약 데이터 업데이트 노보노디스크는 지난 3/7 Capital Market Day에서 경구용 Amylin/GLP-1 작용제 Amycretin 임상1상 데이터를 업데이트했다. 기준점 중간값 체중 ~89%kg의 16명에게서 투약 12주차에 -13.1%의 체중 감소가 나타났다. 위약(-1.1%) 조정할 경우 -12%다. Amycretin의 SubQ 제형에 대해서도 임상1상이 진행 중이며 2025년에 완료가 예상된다. 바이킹도 GLP-1/GIP 작용제 VK2735의 경구제형 임상1상 데이터를 발표했다. 2월에 발표한 VK-2735 SubQ 제형은 투약 13주 후 최대 평균 체중 -14.7%를 감량한 바 있다(위약 조정 -13.1%). 이번 VK2735 oral은 투약 4주 후 최대 용량 40mg에서 -5.3%의 체중 감량 효과를 보였다(위약 조정 -3.3%). 안전성과 내약성도 뛰어났다. TEAE(치료응급부작용)은 경증 또는 중등도로 보고되었고 대부분(79%) 경증이었다. 위장관(GI) 이상 반응도 경증 또는 중등도로 보고, 대부분(79%) 경증이었다. 하반기 임상2상을 시작할 계획이다. 한편, 경구용 비만 신약으로 개발중인 선두 아이템으로 노보의 oral semaglutide가 임상3상, 릴리의 orforglipron이 임상3상 중이다. Oral sema는 68주차 -17.4%의 체중 감량 효과를 보인 바 있고, orforglipron은 36주차 -14.7%의 체중 감량 효과를 보인 바 있다. 다만, oral sema는 합성이 어려운 펩타이드 API semaglutide에 SNAC(salcaprozate sodium) 캐리어를 결합한 구조다. 노보의 SNAC 기술은 생체이용률이 1% 수준인 것으로 알려져 있다. 기존 semaglutide SubQ 제형 대비 생체 이용률이 상당히 떨어진다. 때문에 펩타이드 API 공급 부족 이슈와 연결되어 있다. Amycretin에도 SNAC이 사용되었다. 릴리의 Orforglifron은 합성이 용이한 저분자 화합물로 GLP-1 펩타이드 생산 이슈와 무관하게 대량생산이 가능한 것으로 보인다. 다만, 임상2상에서 임상 중단 비율이 13%(vs. 위약 2%)로 높게 나타난 바 있다. 바이킹 VK2735는 sema처럼 펩타이드 의약품으로 경구제형기술 및 생체이용률에 대해서는 현재까지 공개되지 않았다. 국내에서는 삼천당제약이 경구제형 기술 S-PASS 기반으로 개발 중이다. 지난 3/26, 미국 소재 글로벌 제약사와 경구용 GLP-1 계열 세마글루타이드 성분의 비만, 당뇨병 치료제에 대한 미국 독점 판매 텀싯 계약을 체결했다고 밝힌 바 있다.    |
* [블로그] 펩트론, 주주총회 후기 (2024.03.30)
https://blog.naver.com/redserpent/223400379330
[펩트론] 주주총회 후기
3월 28일 목요일 아침 9시에 펩트론 대전 본사에서 주주총회가 열렸다. 주주총회는 짧게 15분안에 끝나고 1...
blog.naver.com
* 펩트론, 루프원 품목허가 임박...당뇨·비만치료제 기술수출 협상중 (2024.03.25)
https://pharm.edaily.co.kr/news/read?newsId=01882726638826928&mediaCodeNo=257
| 펩트론(087010)이 개발부터 생산까지 ‘바이오 일관생산 체제’를 완성하며, 실적 성장의 기반을 구축했다. 펩트론은 비만·당뇨치료제 기술수출에도 속도를 낼 것으로 기대된다. 식약처, 루프원 품목허가 위한 오송 공장 실사 25일 업계에 따르면 이주 식품의약품안전처가 펩트론 충북 오송 공장을 방문해 류프로렐린 제제의 1개월 지속형 전립선암 및 성조숙증 치료제 ‘루프원’ 생산을 위한 실사를 진행한다. 오송 공장은 200억원을 투자해 2018년 12월 완공한 펩트론의 핵심 자산이다. 임상 시료 및 상업 제품을 생산할 수 있는 의약품제조 및 품질관리기준(GMP) 공장이다. 국내 벤처 제약·바이오사 중 이 같은 시설을 갖춘 곳은 손가락에 꼽는다. 국내뿐만 아니라 유럽 GMP도 충족하며, 최대 생산 가능량은 연간 100만 바이알이다. 큰 이변이 없는 한 식약처 실사 후 루프원 품목허가가 나올 것으로 분석된다. 국내 1세대 바이오벤처인 펩트론이 새로운 전기를 맞는다는 뜻이다. 자체 생산으로 안정적인 수익성을 확보할 수 있어서다. 펩트론은 그간 꾸준한 기술수출로 실력을 증명했지만, 지속 가능한 성장을 위해서는 변화가 필요하다는 지적도 제기됐다. 일반적으로 실사 후 품목허가까지 3~6개월이 걸린다. 루프원 생산은 펩트론의 근본적 변화에 시발점이 될 것으로 전망된다. 루프원은 상업적 성공이 보장됐다는 평가다. 펩트론의 높은 기술력이 이를 증명한다. 루프원은 오리지널 류프로렐린 제제인 일본 다케다제약의 ‘루프린’과 약물동력학(PK)을 세계 최초로, 생물학적 동등성(BE)을 국내 최초로 각각 확보한 제품이다. 루프린은 1989년 출시 후 30년이 넘도록 세계 시장 점유율 1위를 기록하고 있는 대표적인 블록버스터 의약품이다. 업계에서는 루프원이 국내외 1개월 지속형 전립선암 치료제 시장에 ‘게임체인저’가 될 수 있을 것으로 보고 있다. 루프원은 루프린 대비 약물의 입자 크기 및 주사 게이지를 줄여 품질과 투약 편의성을 혁신적으로 개선, 차별화된 경쟁력을 확보했다는 평가를 받고 있다. 국내외 제약·바이오사가 펩트론에 ‘러브콜’을 보내는 배경이다. 실제 이미 국내 루프원 국내 판권은 LG화학(051910)이 확보한 상태다. LG화학은 판매를 맡아 루프원의 국내 전립선암 및 성조숙증 치료제 시장을 본격 공략한다는 전략이다. 해외 판매도 복수의 업체와 논의하고 있는 것으로 알려졌다. 업계에 따르면 국내 류프로렐린 제제 시장 규모는 약 800억 원으로 추정된다. 글로벌 루프린 시장은 연간 2조 7000억원 규모다. 루프원 기반 매출 반전 기대...기술수출에도 긍정 영향 펩트론은 루프원을 바탕으로 매출 반전도 이룰 수 있을 것으로 관측된다. 바이오 소재 등의 판매로 펩트론은 최근 3년간 60억원 내외의 연매출을 냈다. 그러나 연구개발(R&D)에 공격적 투자 등으로 같은 기간 연 150억원 내외의 영업이익 적자도 이어지고 있다. 이 같은 격차는 올해부터 꾸준히 완화될 것으로 관측된다. 루프원 상용화 임박 소식은 진행되고 있는 펩트론의 기술수출에도 긍정적인 영향을 줄 것으로 예상된다. 펩트론은 현재 글로벌 제약사 A, B사 등과 1~2개월 지속형 당뇨·비만치료제와 관련해 협업을 위한 논의를 하고 있다. 긍정적인 내용이 오가고 있는 것으로 알려졌으며, 올해 상반기 결과가 나올 것으로 예측된다. 펩트론의 당뇨·비만치료제 ‘PT403’과 ‘PT404’은 루프원과 마찬가지로 펩트론의 지속성 약물 전달 기술인 스마트데포(SmartDepot)가 적용된 후보물질이다. 업계에서는 펩트론이 PT403과 PT404로 1조원대 이상 규모로 기술수출을 성사할 수 있을 것으로 내다본다. 의약품시장조사업체 이벨류에이트파마에 따르면 글로벌 비만치료제 시장만 따져도 2022년 28억 달러(약 4조원)에서 2028년 167억 달러(약 22조원)로 커진다. 당뇨치료제까지 포함하면 관련 시장은 2028년 100조원을 넘어선다. 펩트론 관계자는 “기술개발뿐만 아니라 상업화 제품의 생산도 가능한 바이오벤처는 국내에서 손가락에 꼽을 정도로 많지 않다”며 “루프원의 상용화 성공과 주요 파이프라인의 기술수출을 통해 기업가치를 높일 수 있도록 노력할 것”이라고 말했다. |
* [블로그] GLP-1 : 비만치료제 시장의 새로운 지형 변화와 CDMO (feat. 일라이 릴리) (2024.03.24)
https://m.blog.naver.com/vlvk1703/223393966117
GLP-1 : 비만치료제 시장의 새로운 지형 변화와 CDMO (feat. 일라이 릴리)
- 최근 노보 노디스크의 캐털란트 인수, 미국의 생물보안법 상원 상임위원회 통과 등으로 비만치료제 시장...
blog.naver.com
* 펩트론, 현금 80억원 확보로 R&D '속도'…"기술 이전도 '순항', 악성 루머 불식" (2024.03.22)
https://www.newsprime.co.kr/news/article/?no=632871
| 펩트론의 대전 국제과학비즈니스벨트 거점지구 토지 처분이 속도를 내고 있다. 본지 취재에 따르면 이미 계약 상대방 선정은 완료됐으며, 계약이 마무리 단계에 들어간 것으로 확인됐다. 약 80억원의 규모의 신약 연구개발(R&D) 및 운영자금을 확보한 펩트론은 시장의 루머를 일축시키고 글로벌 제약사와의 기술 이전도 속도를 낸다는 방침이다. 펩트론이 대전 국제과학비즈니스벨트 거점지구 토지 처분을 이달 내 마무리한다. 이번에 처분하는 토지는 대전시 유성구 둔공동에 위치한 과학벨트 거점지구(둔곡) 산업용지다. 부지 면적은 1만3048㎡로 양도 가격은 약 75억6560만3000원이다. 펩트론 관계자는 본지와의 통화에서 "세부적인 내용은 공시 사항이기에 언급할 순 없지만, 최종 입찰자가 선정됐으며 이달 내 종료될 것"이라고 설명했다. 그동안 펩트론의 부지 매각과 관련해 시장에선 부동산 경기 불황 탓에 매각에 대한 불확실성과 진행 과정에 대한 부정적인 루머가 떠돈 바 있다. 이와 관련해선 "이미 예전부터 기업설명회(IR) 등을 통해 보유한 유휴부지를 매각해서라도 현금을 확보할 것이라고 언급해 왔다. 이것을 실행에 옮기는 것 뿐"이라고 강조했다. 펩트론은 앞서 지난 20일 2023년도 감사보고서를 제출했다. 감사보고서에 따르면 감사의견은 '적정'이다. 내부회계관리제도에 따른 감사(검토)의견 비적정 등도 없었다. 펩트론 관계자는 "감사 의견 ‘부적정’을 받을 것이라는 악성 루머가 떠돌기도 했지만, 공시를 통해 아무런 문제가 없음을 증명했다"고 언급했다. 한편 펩트론은 지난해부터 글로벌 제약사와 지속형 비만 치료제 관련 기술이전 논의를 진행해오고 있으며, 해당 결과에 시장이 계속해서 주목하고 있는 상황이다. 현재 진행 상황과 관련해선 "다만 비밀유지계약 등으로 인해 상세한 부분까지 설명해드릴 수 없다. 다만, 현재 계획처럼 순조롭게 진행되고 있는 것은 확실하다"고 답했다. |
* [블로그] 펩트론, 지투지바이오 노이즈(?) 관련... (2024.03.22)
https://blog.naver.com/redserpent/223391294639
[펩트론] 지투지바이오 노이즈(?) 관련...
네이버 종토방에서 "지투지바이오" 노이즈가 많은 것 같다. 그래서 이와 관련하여 내 생각을 정...
blog.naver.com
* [블로그] 펩트론, GLP-1 1개월 제형 GMP grade 생산 성공, L/O 계약이 임박했다면... (2024.03.18)
https://m.blog.naver.com/redserpent/223386572307
[펩트론] GLP-1 1개월 제형 GMP grade 생산 성공, L/O 계약이 임박했다면...
펩트론에 대한 기본적인 내용은 이 글 맨 밑에 링크한 글들을 참조하면 된다. Episode.1 GLP-1 1개월 ...
blog.naver.com
* [블로그] 펩트론, 비만치료제 대장주 다시 일어설까 (2024.03.10)
https://m.blog.naver.com/raise-mon/223378916973
펩트론, 비만치료제 대장주 다시 일어설까
작년부터 지금까지 비만치료제는 제약바이오의 한축을 담당하고 있다. 비만치료제 관련 전세계를 양분하고 ...
blog.naver.com
* 노보노디스크 Capital Market Day 프레젠테이션 자료 (2024.03.07)
- Sustained release : 서방형
* 펩트론 IR Book (2024.03.06)
* [회사 공지] 주요 진행상황에 관한 업데이트 (2023.02.27)
http://www.peptron.co.kr/ds4_1_1.html?db=newsp&no=85&c=view&page=1&SK=&SN=&kind3=&idx=

* [블로그] 펩트론 : 또 다른 갈피, 채용 공고가 지닐 함의? (2024.02.18)
https://m.blog.naver.com/vlvk1703/223357573081
펩트론 : 또 다른 갈피, 채용 공고가 지닐 함의?
* 필자 본인은 작년 6월말 경을 기점으로, 해당 종목을 지속 보유 중인 주주로서 보유자 편향이 존재할 수 ...
blog.naver.com
* [블로그] 펩트론 : 정황과 갈피, 일라이 릴리의 컨퍼런스 콜과 암젠의 AMG-133 (2024.02.13)
https://blog.naver.com/vlvk1703/223351562514
펩트론 : 정황과 갈피, 일라이 릴리의 컨퍼런스 콜과 암젠의 AMG-133
* 필자 본인은 작년 6월말 경을 기점으로, 해당 종목을 지속 보유 중인 주주로서 보유자 편향이 존재할 수 ...
blog.naver.com
* [회사 공지] 주요 진행상황에 관한 업데이트 (2023.01.24)
http://www.peptron.co.kr/ds4_1_1.html?db=newsp&no=84&c=view&page=1&SK=&SN=&kind3=&idx=

* 살 빼면서, 주가는 벌크업 - 삼성증권 (2023.01.23)
| • GLP-1 RA 중심의 비만/당뇨 시장, 2032년까지 만성질환 치료제로 성장 가능성 감안하면 1,440억 달러 규모까지 성장 기대. 비만 시장 성장 잠재력은 무궁무진: 글로벌 제약사 중에서는 Novo Nordisk, Eli Lilly를 Top picks로 제시. 바이오 기업으로는 Zealand, Terns, Neurobo, Biohaven, Scholar Rock, Keros 등에서 신규 기전의 비만 치료제 개발 중. 글로벌 제약사의 비만 치료제 파이프라인 확대로 해당 바이오 기업과의 협업 기대. 비만 관련 ETF(해외 TEMA ETF; 2023년 11월 출시, 국내 삼성자산운용 ETF; 2월 출시 예정 iSelect 글로벌 비만 치료제 지수 추종 예정)도 상장. 몸에 새겨진 비만 유전자로 인한 다이어트와의 끝없는 싸움: 인간은 수백만년 전의 수렵/채집 시절 생존에 유리했던 비만 유전자를 지금까지 보유. 영양 과잉 시대에서 비만 유전자로 인해 지방이 축적되도록 설계됨. 1980년 이후 글로벌 비만율은 급격히 증가(특히 미국 비만율 1994년 22.9% vs 2018년 42.4%). 비만율 증가는 비만 관련 합병증 증가로 연결, 미국에서는 2016년 비만 관련 의료비용으로 1,727억 달러 지출. 비만은 완치가 어려우며(재발률 99.6%), 식이조절+운동만으로 체중 조절이 어려운 비만 환자에게 비만 치료제 처방을 통한 적극적 관리 필요. GLP-1 RA, 비만/당뇨 외에 만성질환 치료제로 시장 확대 기대: 기존 비만 치료제는 식욕억제제, 지방흡수억제제 등으로 부작용과 미미한 효능으로 새로운 기전의 비만 치료제 개발 필요. Novo Nordisk, Eli Lilly에서 GLP-1 RA 기전의 비만 치료제 발매. Novo Nordisk의 Semaglutide(GLP-1 RA), 68주 동안 16% 체중 감소. Eli Lilly의 Tirzepatide(GLP-1/GIP), 72주 동안 20% 체중 감소 효과 확인. GLP-1 RA는 비만/당뇨에서의 효과뿐만 아니라 비만 관련 만성질환(심혈관, 만성콩팥병, MASH, 알츠하이머 등) 등에서도 효과 입증. 2032년 GLP-1 RA 시장 규모 1,440억 달러 규모까지 성장 기대. 현재 GLP-1 RA 시장은 Eli Lilly, Novo Nordisk가 독점 중. 후발 경쟁 제품 시장 발매 시점 고려 시 향후 2~3년 이상 과점할 것으로 전망. 새로운 GLP-1 RA 개발 중: GLP-1 RA 단일제 및 GLP-1/GIP 이중 작용제 외에 GLP-1/GCG, GLP-1/GIP/GCG 등 혈당 강화 효과 및 체중 감소 효과가 더 좋은 작용제 개발 중. 또는 펩타이드 경구용 GLP-1 RA의 단점을 보완하기 위해 비펩타이드 경구용 GLP-1 RA 개발도 증가. 최근 Pfizer가 연이어 실패했지만, Eli Lilly, AstraZeneca, Roche 등에서도 활발히 개발 중. GLP-1 RA외에 신규 기전으로 Amylin 유도체 또는 근육 감소 방지를 위해 Activin 또는 Myostatin 억제 기전의 치료제와 GLP-1 RA 병용 요법으로 개발 예정. GLP-1 RA 부작용은 극복 가능: GLP-1 RA에 대한 우려로는 1) 요요 현상, 2) 자살 충동 등이 있음. 요요 현상은 GLP-1 RA 기전의 비만 치료제뿐만 아니라 일반적인 다이어트 시에 95% 확률로 발생. 최근 Eli Lilly의 Tirzepatide 임상에서 유지 요법으로 투약 시 요요 현상 없이 정상 체중이 유지 확인. GLP-1 RA 투약과 함께 운동을 병행하면 역시 효과적인 체중 유지 가능. 체중 유지를 위해서 GLP-1 RA 장기 투약보다는 생활 습관 개선이 중요. 미국/유럽 규제기관에서 GLP-1 RA와 자살 충동에 대한 연관성 조사 중. 최근 연구에 따르면 GLP-1 RA 복용이 다른 비만 치료제 대비 자살 충동을 늘린다는 우려는 없는 것으로 확인되나, 추가적인 연구는 필요. 미용 관점이 아닌 치료 관점에서 비만 관리 필요 (살이) 빠질수록 (비만 시장은) 커진다 장기 지속형 GLP-1 RA 출시 이후 비만 치료제 시장 개화. GLP-1 RA은 비만/당뇨 치료외에 만성질환 치료제로 영역 확대 기대. GLP-1 RA 성장 잠재력 감안 시 여전히 매력적인 투자처라 판단. 비만 시장에 대한 투자 포인트 • 비만인에 대한 적극적인 관리 필요: 1980년 이후 글로벌 비만 인구 비율은 꾸준히 늘어나고 있으며, 비만 관련 합병증으로 인한 의료 비용 부담도 증가하고 있다. 영양 과잉 시대에서 우리 몸에 새겨진 비만 유전자로 인해 끊임없이 다이어트를 해야 한다. 식이조절+운동 만으로 정상 체중을 유지할 수 있다면 가장 좋겠지만, 운동기능 장애가 있는 비만인에게는 적절한 비만 치료제가 절실하다. • 기존 비만 치료제 대비 우수한 GLP-1 RA: 기존 치료제는 식욕억제제, 지방흡수억제제 등으로 단기 처방만 가능하거나, 체중 감소 효과가 미미했다. 하지만 최근 발매된 GLP-1 RA 계열의 비만 치료제는 체중 감소 효과가 매우 우수하다. 운동과 병행했을 경우 요요현상 없이 정상 체중 유지가 가능하다. • GLP-1 RA의 시장 성장 잠재력은 무궁무진: GLP-1 RA는 당뇨 치료제뿐만 아니라 비만 치료제로써 가파른 성장세가 이어지고 있다. Novo Nordisk와 Eli Lilly가 GLP-1 RA의 더 큰 활용을 위해 시행한 임상에서 비만 관련 만성질환(심혈관, 만성콩팥병, MASH, 알츠하이머 등) 등에서 효과가 있다는 것이 계속 입증되고 있다. 국가별 규제기관에서도 GLP-1 RA에 대해 많은 사람들이 혜택을 받을 수 있도록 보험 급여를 확대한다면, 중장기적으로 비만 관련 합병증에 소비되는 의료 비용을 줄일 수 있을 것이다. • GLP-1 RA 부작용은 극복 가능: 다만, GLP-1 RA의 부작용도 무시할 수 없다. GLP-1 RA의 대표적인 부작용은 지방과 함께 근육도 함께 감소하는 것이다. 최근 GLP-1 RA와의 병용으로 근육 소실을 억제하는 파이프라인 개발이 활발하다. 또 다른 부작용은 요요 현상이다. GLP-1 RA와 같은 비만 치료제뿐만 아니라 일반적인 다이어트 시에 요요 현상은 95% 확률로 나타난다. 최근 Eli Lilly의 Tirzepatide 임상에서 유지 요법으로 투약 시 요요 현상 없이 정상 체중이 유지된 것을 확인할 수 있다.  비만/당뇨 시장을 과점하는 글로벌 제약사에 주목 • Novo Nordisk: Novo Nordisk의 2023년 매출액은 334.1억 달러(+33.4% y-y), 영업이익은 147.8억 달러(+38.0% y-y)로 전망된다(Bloomberg). Novo Nordisk의 주요 제품은 Ozempic(당뇨 치료제, Semaglutide), Wegovy(비만 치료제, Semaglutide), Rybelsus(경구 당뇨 치료제, Semaglutide) 등이 있으며, 전체 매출의 50%를 차지한다. Wegovy는 2022년 발매 이후 주사 편의성(1주 제형), 우수한 체중 감소 효과 덕분에 인해 미국에서 처방이 급격히 증가했다. Wegovy 보험 급여는 BMI 지수 30 이상인 고도 비만 환자에게 보장이 가능했으며, Wegovy 처방을 받기 어려우나, 제2형 당뇨를 가진 환자의 경우 Wegovy 대신 Ozempic 처방을 선호하여 Wegovy와 함께 Ozempic 처방도 늘어났다. Rybelsus는 2023년 1월 FDA로부터 제2형 당뇨 환자 대상 1차 치료제 승인 이후 의사들의 적극적인 처방 확대로 가파른 성장세가 이어지고 있다. 미국, 유럽 외에 아시아 지역에서도 Semaglutide 제품의 매출 성장이 기대된다. • Eli Lilly: Eli Lilly의 2023년 매출액은 336.6억 달러(+17.9% y-y), 영업이익은 72.4억 달러(-12.5% y-y)로 전망된다(Bloomberg). Eli Lilly의 주요 제품인 Trulicity(당뇨 치료제, Dulaglutide), Taltz(염증치료제), Verzenio(유방암 치료제) 등이 매출 비중 50% 이상을 차지하고 있으며, Mounjaro(당뇨 치료제, Tirzepatide), Zepbound(비만 치료제, Tirzepatide), Jaypirca(혈액암 치료제), Omvoh(궤양성 대장염 치료제) 등의 신제품 매출이 가파르게 성장하고 있다. Eli Lilly는 비만/당뇨 외에도 자가면역 질환 치료제, 항암제 등 다양한 분야에서 신제품을 발매하면서 포트폴리오를 강화하고 있으며, 1Q24에는 알츠하이머 치료제 Donanemab에 대해 FDA 품목 허가 모멘텀도 보유하고 있다.  글로벌 제약사의 비만 치료제 파이프라인 확대로 M&A 또는 라이선스 계약 기대되는 기업 • 이중 또는 삼중 작용제: 최근 이중 작용제(GLP-1/GCG 또는 GLP-1/GIP)에 대한 글로벌 제약사의 기술 도입이 늘어나고 있으며, Eli Lilly의 삼중 작용제(GLP-1/GCG/GIP)는 기존 단일제 및 이중 작용제 대비 우수한 체중 감소 효과를 보인만큼 삼중 작용제에 대한 개발도 확대될 것으로 기대한다. 이중 작용제 개발 업체로는 Zealand Pharma(Dapiglutide P2), Viking(VK2735 P1), Neurobo/동아에스티(DA-1726 P1) 등이 있으며, 삼중 작용제로는 한미약품(HM15211 MASH P2, LA-GLP-1/GCG/GIP 전임상)이 개발하고 있다. • GLP-1 RA 경구제 개발 기업: Novo Nordisk의 Semaglutide의 경구용 브랜드인 Rybelsus는 주사를 기피하는 환자들에게 처방이 선호되고 있다. 경구 Semaglutide에는 Semaglutide와 sodium N-[8-(2-hydroxybenzoyl) amino] caprylate(SNAC)와 복합체로 구성되어 있으며, SNAC가 유리되면서 국소적으로 pH를 증가시켜 Semaglutide의 분해를 억제하면서 위점막을 통한 흡수를 촉진한다. 이 기술은 Novo Nordisk가 독점하고 있기 때문에 경구용 GLP-1 RA를 개발하고자 하는 후발 주자는 새로운 플랫폼 기술을 개발하거나, GLP-1 RA를 위 점막에서 분해되는 펩타이드가 아닌 저분자 합성 구조의 비펩타이드(non-Peptide)로 개발하고자 한다. Eli Lilly, Pfizer 등이 비펩타이드 경구용 GLP-1 RA를 개발하고 있으며, 최근에 Pfizer는 간독성 이슈로 인한 연이은 임상 실패를 겪었다. 바이오 기업 중에서는 경구용 치료제를 개발하는 업체는 다음과 같다. Structure에서는 GSBC-1290에 대해 2024년 하반기 임상 2b상을 개시할 예정다. Terns에서 TERN601를 개발하고 있으며, 지난 4Q23에 임상 1상을 개시, 2024년 하반기에 결과 발표가 예정되어 있다. Neurobo/동아에스티는 GPR119 작용제인 DA-1241(경구; 저분자)에 대해 현재 MASH 치료제로 P2 진행 중에 있으며, 향후 비만 치료제로도 개발할 예정이다. • 신규 기전: GLP-1 활성화 기전 외에 새로운 기전의 비만 치료제 개발도 활발히 이루어지고 있다. 글로벌 제약사는 비만/당뇨 포트폴리오 확장을 위해 새로운 기전을 개발 중인 바이오 기업과의 활발한 협업이 예상된다. 1) Amylin 유도체: Amylin 유도체는 중추신경계에 직접 작용하여 식욕을 억제하는 효과가 있다. Novo Nordisk는 Semaglutide와 Amylin 유도체인 Cagrilintide와 복합제로 비만 임상 3상을 진행하고 있다. 그 외에는 AstraZeneca의 AZD623(23.11 P1 개시, 2024년 하반기 임상 종료), Zealand의 ZP8396(P1b)가 있다. 2)근육 감소 방지: GLP-1 RA 장기 복용 시 나타나는 부작용인 근육 감소를 방지하기 위한 노력도 이루어지고 있다. 척수성 근위축증 치료의 잠재적 표적으로 주목받고 있는 Myostatin 억제 기전으로 Roche의 RG6237, Regeneron의 Trevogrumab 등이 개발되고 있으며, 그 외에 바이오 기업 중에서는 Biohaven(Taldegrobep alpha P2), Scholar Rock(SRK-439+apitegromab P2), Keros(KER-065 P1) 등이 GLP-1 RA와 병용으로 전임상 결과를 확보하면서 임상 1, 2상에 진입했다. 근육 감소를 억제하는 기전으로 Activin type II 수용체의 활성화를 억제하는 방법이 있다. 최근 Eli Lilly는 Versanis에서 개발한 Bimagrumab을 인수하여, Semaglutide와 병용 임상을 진행하고 있으며, Regeneron의 Garetosmab 역시 Semaglutide와 병용 요법으로 임상 2상을 2024년 중순에 개시할 예정이다. 추가적으로 Semaglutide+Garetosmab+Trevogrumab 삼중 요법 임상도 진행할 예정이다. 다른 기전으로는 Veru의 Enobosarm이 있다. Enobosarm은 선택적 안드로겐 수용체 조절제로 2010년대에 암 환자 대상 근육 소실 치료 목적으로 개발되었지만 임상에 실패했다. 이를 Veru가 인수하여 비만인 대상 2024년 1분기 내로 임상 2상을 진행하여 연내 임상 결과를 발표할 예정이다.    비만, 미용이 아닌 질병 내재화된 비만 유전자는 생존을 위한 것이었다. 인간의 유전자에는 몇십만 년 전부터 비만의 원인이 새겨져 있다. 수렵과 채집을 통한 제한적인 먹이 활동으로 인해 먹을 것을 구하기 어려워 인간은 지속적으로 굶주림에 시달렸으며, 잦은 굶주림은 생존과 직결되었다. 식량이 부족한 상황에서 오랜 시간 생존하기 위해서는 에너지를 보다 효율적으로 저장할 수 있는 시스템을 갖추는 것이 유리했다. 지방은 에너지를 저장하기 위한 최적의 비상 식량으로 동일한 양의 식사를 하더라도 더 많은 양의 지방을 지니는 사람이 생존에 유리하다. 즉 아주 오래 전에는 지방을 잘 저장할 수 있는 사람이 생존 가능성이 높았던 것이다. 지방의 저장은 인류 진화에서 중요한 역할을 해왔다. 인류 진화 과정에 새겨진 지방 축척을 통한 생존 시스템이 식량 공급 과잉 시대에 살고 있는 현대인에게 이어졌다. 현대인에게 지방의 축적은 더 이상 생존을 위한 축복이 아니라, 비만에서 벗어나기 위해 끊임없이 다이어트를 해야 하는 불필요한 요소가 되어버렸다.  비만 환자는 늘어날 수밖에 없다. 영양 과잉 시대에서 사람은 칼로리를 소모하는 양보다 더 많이 섭취하게 된다. 섭취된 칼로리는 소비되지 않으면 지방으로 축적된다. 탄수화물의 경우 글리코겐 형태로 간과 근육에 저장되다가 글리코겐 저장 한계를 넘을 경우 잉여 포도당은 지방으로 바뀌게 된다. 글리코겐 1kg을 빼기 위해서는 1,200kcal만 소비하면 되지만 지방 1kg을 빼기 위해서는 7,000kcal를 소비해야 한다. 7,000kcal를 섭취하기 위해서는 야식으로 양념치킨을 3-4마리를 먹으면 되나, 7,000kcal를 소비하기 위해서는 70kg인 사람이 6km/h로 19시간을 걸어야 한다. 지방이 많이 축적될수록 살을 빼기 위해서는 더 많은 칼로리를 소모하기 위한 노력을 해야 한다. 2000년 WHO 가이드라인에 따라 아시아인 비만 기준은 Body Mass Index(BMI)≥25 kg/m2 인 경우로 정했으나, BMI 25 기준으로 봤을 때 심혈관질환 사망률이 크게 증가하지 않는다. 현재 미국인 기준 BMI 30 이상의 경우 비만으로 구분하고 있다. 따라서 아시아인과 서양인 모두 비만의 기준은 BMI 30으로 정의되고 있다.  비만, 완치가 어렵다. 비만은 재발성 만성질환으로 분류된다. 비만인들은 체중 감량을 하더라도 다시 체중이 증가하는 경우가 많으며, 감량한 체중을 장기간 유지하는 경우는 드물다는 연구 결과들이 많다. 사람은 외부 변화에도 안정적으로 내부 시스템을 유지하는 항상성을 갖고 있다. 체중 감량 과정은 인체 관리 시스템인 항상성과 끊임없이 싸워야 한다. 다이어트를 시작하면 에너지 소비가 줄어들면서 식욕이 증가하기 때문에 체중 감량을 지속하기 어렵다. 체중이 줄면 식욕을 자극하는 호르몬인 그렐린이 급격하게 늘어나는 반면 식욕을 억제하는 렙틴 호르몬은 감소하면서 체중 유지가 더욱 어려워진다. 다이어트를 할수록 오히려 비만은 늘어난다. 실제로 대부분의 다이어트의 끝은 요요 현상으로 인해 체중이 다이어트 전으로 회복되거나 오히려 그 이상으로 증가하는 경우가 많다. 영국에서 2004년-2014년 사이의 영국 국립보건연구소 데이터를 분석한 연구에 따르면 176,495명(남자 77,704명, 여자 99,791명)의 참가자의 체중 및 BMI 기록을 추적한 결과 2년 안에 본래 체중으로 돌아올 가능성은 53% 였으며, 5년 안으로는 78% 였다. BMI 지수가 30-35인 비만인 중에서 정상 체중에 도달한 사람은 연간 기준 남자는 210명 중 1명, 여자는 124명 중 1명이었으며, BMI 40 이상의 고도 비만인에서는 남자 1,290명 중 1명, 여자 677명 중 1명으로 나타났다. 고도 비만인들은 식이요법, 운동 등 생활습관을 개선하는 것이 어렵기 때문에 수술이나, 비만 치료제와 같은 도움이 필요하다. 비만은 만성질환이기 때문에 장기적이고 지속적인 치료가 필요하다.  미국, 비만 치료제가 절실한 국가이다. 글로벌 비만 환자의 비율은 지속적으로 늘어나고 있으며, 그중 가장 으뜸은 미국이다. 2021년 조사된 연구에 따르면 미국인 10명 중 4명은 비만이다(BMI 30이상). 즉 2021년 기준 미국 인구 3.3억명 중 1억명 이상이 비만 환자라는 것이다. 미국의 비만율은 1980년대부터 증가하면서, 1990-2000년대에 폭발적으로 늘어났다. 비만 인구가 급증한 이유는 1) 농업정책의 변화로 낮아진 식료품 가격, 2) 맞벌이로 인한 외식 증가, 3) 패스트푸드에서 제공되는 음식량 증가(맥도날드 감자튀김 칼로리 변화: 1960년대 200kcal vs 2024년 510kcal), 4) 소득 격차에 따라 빈곤층 비만 증가 등에서 기인된다. 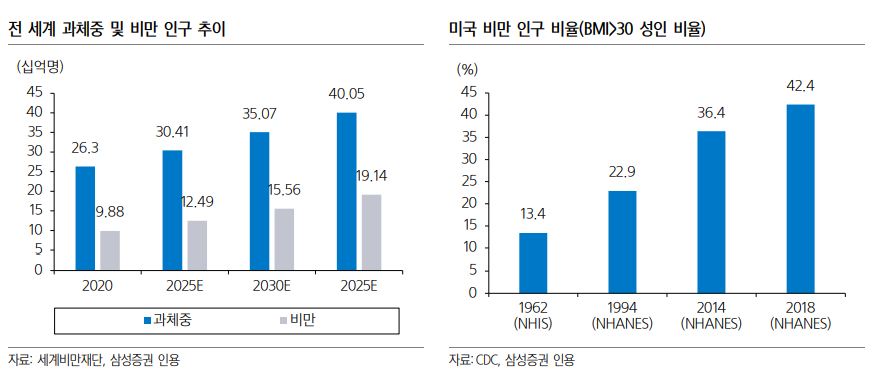 비만으로 인한 사회적 비용은 계속 늘어나고 있다. 적극적인 정책 개입이 필요하다. KIRI 리포트(보험연구원, 김혜란)에서는 비만으로 인해 2035년까지 매년마다 세계 GDP의 3%에 해당되는 경제적 손실이 발생될 것으로 전망했다. 비만으로 인해 고혈압, 고지혈증, 당뇨, 심혈관 질환 등과 같은 각종 합병증도 증가되면서, 사회/경제적 부담도 늘어나고 있다. 지난 10년간 미국 내 비만 인구가 꾸준히 증가하면서 비만과 직/간접적으로 관련된 의료 지출도 증가했다. CDC(미국질병통제예방센터)의 자료에 따르면 2016년 미국에서 비만 관련 의료비는 1,727억 달러로 추정되며(MILKEN institute), 2021년 연구에 따르면 미국에서 비만 환자는 비만이 아닌 사람보다 연 평균 1,861달러 이상의 의료비를 더 지출하는 것으로 확인되었다(Ward et al., 2021). 또한 비만으로 인해 임금 차별(Wage Discrimination), 직장 생산성(Productivity), 결근(Absenteeism), 의료 보험비 증가, 자동차 연비 등과 같은 간접 비용도 경제적 손실로 이어진다. 특히 비만인 관련 비용 중에서 의료 비용을 제외할 경우, 비만인에 대한 임금 불평등으로 인한 경제적 비용이 큰 비중을 차지하고 있다. 미국 공중보건학회지에 발표된 논문에는 미국에서 인종 차별과 함께 체중 차별에 대해 언급하고 있다. 전반적으로 과체중 또는 비만인 직원들은 임금이 적거나 승진에서 배제되는 경우가 있다. 뉴욕시에서는 인종, 성별, 나이, 종교, 성적 차별을 금지하고 있는 데에 이어 지난 11월 22일에는 추가로 키와 몸무게에 대한 차별을 금지하는 내용의 조례를 발표했다. 비만인에 대한 차별을 금지함으로써 관련된 경제적 비용을 낮출 수 있는 것은 긍정적이나, 근본적인 해결책은 되지 않는다. 여전히 현대 사회에서는 비만을 사회적 문제로 인식하는 것이 아니라 미용적 관점으로 바라보고 있다. 비만을 사회적 문제로 받아들이는 인식 변화가 필요하며, 각 국가별로 비만에 대한 적극적인 정책을 제시해야 할 것이다.  비만 치료제 개발의 필요성 과거 비만 치료제의 아쉬운 점 • 식욕억제제(Appetite suppressants): 1959년에 FDA 승인된 Phentermine(펜터민)은 뇌에서 포만감을 증가시키고 배고픔을 덜 느끼게 하는 신경물질 노르에피네프린을 선택적으로 분비하는 기전의 비만 치료제로 마약류로 분류되어 있다. 펜터민 외에 펜디메트라진, 디에틸프로피온, 마진돌 등과 같은 항정신성 약물에 속하는 식욕억제제는 장기 복용 시에 심각한 부작용이 나타날 수 있기 때문에 4주 단기 처방 또는 3개월 이내 처방을 권고하고 있다. 반면, Qsymia(Phentermine/topiramate; 2012년 FDA 승인), Contrive(Naltrexone/bupropion; 2014년 FDA 승인)는 항정신 약물이 아닌 자율신경제로 허가 받으면서 투여 기간의 제한이 없다. • 지방흡수억제제(Malabsorption): 대표적인 제품은 Xenical(Orlistat)로 1999년 FDA 승인을 받았다. 지방을 분해하는 효소인 Lipase를 억제하여 지방의 가수분해가 덜 되면서 섭취한 지방의 30% 흡수를 억제한다. 장기 사용이 가능한 장점이 있으나, 15-30% 정도는 부작용으로 복부 팽만감, 지방변 등이 나타난다. GLP-1 RA 비만 치료제의 혁명 • GLP-1 RA(GLP-1 receptor agonist): 당뇨 환자들에게 처방되는 대표적인 치료제는 GLP-1(Glucagon like Peptide) 유사체로 췌장의 베타 세포를 활성화시켜 인슐린을 분비하여 혈당을 조절한다. 오리지널 GLP-1의 반감기는 약 2분 정도로 매우 짧기 때문에 의약품으로 사용되기 위해서는 반감기를 늘린 변형 GLP-1 개발이 필요하다. 변형된 GLP-1 유사체는 GLP-1 receptor agonist(GLP-1 수용체 길항제)를 줄인 GLP-1 RA라 불린다. 흥미로운 점은 당뇨 치료제로 출시된 Novo Nordisk의 GLP-1 RA인 Victoza(Liraglutide)를 장기 추적한 결과에서 부작용으로 식욕 부진과 체중 감소를 확인하면서 비만 치료제로 개발을 확대하여 동일 성분으로 Saxenda(Liraglutide)를 발매했다는 것이다. Saxenda(Liraglutide, 일 1회 투여)는 2014년 미국 FDA로부터 승인을 받았으며, 장기 사용이 가능한 비만 치료제이다. 위장 관련 부작용이 가장 흔하며 대부분은 시간 지나면 호전된다. GLP-1은 인슐린 분비를 촉진하는 것 외에 뇌의 식욕 중추를 조절하여 식욕을 억제하는 기능이 있다. 또한 음식물이 위에서 배출되는 것을 지연시켜 탄수화물 흡수를 느리게 하여 급격한 혈당 상승을 막을 수 있다. Saxenda의 출시는 비만 치료제 처방에 있어 혁명이었다. 식욕억제제의 치명적 부작용, 지방흡수억제제의 아쉬운 효능으로 인해 새로운 기전의 비만 치료제가 필요했다. • GLP-1 RA 투약으로 요요 현상 예방: 2021년 덴마크 연구팀이 보고한 연구에 따르면 BMI 32-43인 비만인 215명 대상으로 위약, Saxenda(Liraglutide), 운동, Saxenda+운동으로 네 그룹으로 나눴다. 1년 후에 위약군은 체중이 다시 늘어났으나, Saxenda 처방을 유지하거나 운동을 꾸준히 한 경우에는 체중이 유지되었다. Saxenda 투약과 함께 운동을 한 그룹은 체중이 오히려 빠진 것을 확인할 수 있으며, 건강 관련 바이오 지표도 훨씬 개선되었다.   업그레이드된 GLP-1 RA GLP-1 RA는 끊임없이 진화하고 있다. 하루 2회 주사 제형에서 하루 1회, 그리고 주 1회 주사 제형으로 개발되면서 환자의 투약 편의성을 개선시켰다. 최근에는 경구용 GLP-1 RA도 출시되면서 주사 제형을 기피하는 환자들에게 선호되고 있다. 또한 혈당 강하 및 체중 감소 효과를 강화하기 위해 GLP-1 단일제에서 GIP, Glucagon 수용체도 동시에 활성화시킬 수 있는 복합제 개발도 활발히 이루어지고 있다. • GLP-1 RA 1주 제형: 2014년 1주 1회 주사 제형의 GLP-1 RA로 Eli Lilly의 Trulicity(Dulaglutide)가 FDA로 부터 승인을 받았다. 기존 Novo Nordisk의 Victoza 대비 개선된 편의성으로 가파른 성장세가 이어졌다. Eli Lilly는 Dulaglutide 성분에 대해 당료 치료제인 Trulicity만 발매했으나, Trulicity의 임상 3상 결과에서 체중 감소 효과가 확인되었던 만큼 BMI 지수가 높은 당뇨 환자들에게 처방 선호도가 높았으며, 당뇨가 없는 비만인에게도 오프라벨(허가한 용도 이외의 적응증에 대해 약 처방)로 처방이 되었다. Novo Nordisk는 Trulicity를 견제하기 위해 혈당 강화 효과와 체중 감소 효과가 보다 우수한 1주 제형의 GLP-1 RA 성분인 Semaglutide를 개발했다. 당뇨 치료제로 Ozempic(Semaglutide)에 대해 2017년 FDA 승인을 받아 발매했다. Eli Lilly와는 차별적인 전략을 가져가기 위해 Novo Nordisk는 Saxenda에 이어 Wegovy(Semaglutide)라는 비만 치료제를 발매했다. Semaglutide의 체중 감소 효과는 인플루언서들을 통해서 한번 더 입증되면서 미국에서 선풍적 인기를 끌게 되었다. 일론 머스크는 Wegovy 투약으로 30파운드(13.6kg)을 감량했다고 밝혔으며, 오프라 윈프리는 피플지 인터뷰에서 Ozempic 투약으로 40kg을 감량했으며, 비만은 의지 문제가 아닌 질병이라고 언급한 바 있다  • GLP-1/GIP 복합 1주 제형: Eli Lilly도 Novo Nordisk의 Semaglutide에 대항할 수 있는 새로운 GLP-1 RA가 필요했다. Eli Lilly는 GLP-1 수용체만을 자극하는 단일 기전이 아니라 GLP-1 수용체와 함께 인크레틴 호르몬인 GIP 수용체를 동시에 자극하는 이중 기전의 GLP-1/GIP 성분의 Tirzepatide를 개발했다. 제품으로 2022년 2분기 당뇨 치료제 Mounjaro(Tirzepatide, 1주 제형) 발매에 이어 2023년 4분기 비만 치료제 Zepbound(Tirzepatide, 1주 제형)를 발매했다. 따라서 현재 처방 가능한 GLP-1 RA 계열의 비만 치료제로는 1일 제형의 Saxenda, 1주 제형의 Wegovy, Zepbound가 있다. • GLP-1 RA 경구형 제형: 1주 제형으로 주사 주기가 개선된 것은 분명 혁신이다. 하지만 주사를 기피하는 사람도 있기 때문에 새로운 제형에 대한 개발이 필요했다. GLP-1 RA는 아미노산으로 구성된 펩타이드 성분으로 이루어져 있기 때문에 경구 복용 시에 위에서 위산에 의해 펩타이드가 분해된다. GLP1 RA를 경구용으로 개발하기 위해서는 위산으로부터 펩타이드를 보호하면서 위에서 흡수된 펩타이드가 혈액으로 이동시킬 수 있는 플랫폼 기술이 필요하다. Novo Nordisk는 2009년부터 Emisphere 기업과 협업하여 경구형 제제 변형 기술인 Eligen 기술을 활용한 GLP-1 RA 파이프라인 확보했으며, 2020년에는 18억 달러 규모로 Emisphere를 인수하면서 기술에 대해 독점권을 확보했다. Eligen 기술이 적용된 경구용 Semaglutide를 개발하여 당뇨 치료제로 Rybelsus라는 브랜드를 FDA로 2019년 허가 받아 발매를 했다. 경구용 Semaglutide에 대해 비만 환자 대상 임상 3상도 최근에 완료를 했으며, 68주 복용한 결과 대조군은 2.4% 체중이 감소한 반면 경구용 Semaglutide 복용한 환자는 15% 체중 감소 효과가 나타났다. 다만 Novo Nordisk는 펩타이드 생산 capa 부족으로 고용량이 필요한 경구용 semaglutuide에 대해 비만 치료제로 발매할 지에 대해서는 미정이라고 언급한 바 있다.  GLP-1 RA의 확장성 GLP-1 RA, 비만/당뇨에서 만성질환 치료제로 Eli Lilly, Novo Nordisk의 장기지속형 GLP-1 RA 치료제는 비만/당뇨 분야에서 처방이 가파르게 늘어나면서 주목을 받았다. GLP-1에 대한 연구는 비만, 당뇨에 그치는 것이 아니라, 심혈관, 심근염, 말초혈액질환 외에 MASH, 알츠하이머 등 혈관질환 및 염증 질환 분야에서도 GLP-1의 효능을 확인하기 위한 임상이 진행되고 있다. GLP-1의 새로운 잠재력: GLP-1을 통한 신호 전달 활성화는 염증 반응을 감소시키는 것으로 밝혀졌다. GLP-1 RA의 초기 제제인 Liraglutide는 산화 스트레스와 염증을 감소시켜 패혈증에서의 혈관 기능을 향상시켰으며, Nf-κB의 활성화 감소, TNF-α 억제, 산화질소 생성 증가 등으로 내피세포에서의 항염증 효과를 확인했다. Exenatide는 조절 T세포를 활성화시켜 염증 반응을 줄였다. GLP-1은 간, 심장 등 여러 조직에서 염증 반응을 낮추는 효과가 입증됐다. • 심장: 만성 심부전증 환자 및 심근병증 환자에서 GLP-1 투약은 심장 기능을 향상시켰으며, 심근 경색 후 생존율도 개선시켰다. 지난 8월 Novo Nordisk는 17,000명 당뇨가 없는 비만 및 심혈관 환자 대상 SELECT 임상 3상에서 Semaglutide 투약시 심혈관계 위험도(MACE)를 20% 이상 낮췄다는 결과를 발표했다. 미국 공보험인 Medicare 및 사보험에서 Wegovy의 처방을 제한하고 있는만큼 이번 임상 결과로 보험 적용 확대가 기대된다. 연이어 박출률 보존형 비만 관련 심부전 환자 대상 STEP-HFpEF 임상 3상에서 Semaglutide는 심근병증 증상을 낮추는 것으로 확인되었다. • 장질환: 최근 여러 연구에서는 GLP-1은 상피 세포의 재생, T세포의 성장 및 기능 조절, 선척 면역 세포의 조절을 통해 염증성 장질환, 단장 증후군 등 광범위한 장질환 치료제로 효과가 확인되었다. • 간담도: GLP-1 치료는 비알콜성 지방간 질환과 비알콜성 지방간염과 같은 간 질환에서의 개선 가능성도 보였다. 비알콜성 지방간염은 지방이 축적되어 발생하는 간염증과 관련 있다. GLP-1 치료는 간세포의 괴사와 세포 사멸을 줄여 염증 반응을 낮출 수 있다. 또한 지방을 감소시켜 염증의 원인이 되는 지방간 수치도 낮출 수 있다. • 중추신경계: GLP-1 RA는 혈액-뇌 장벽 투과성이 좋아 뇌에서 식욕을 조절하는 호르몬을 조절하기 때문에 뇌 질환 치료제로 직접적으로 사용될 수 있다. 치매는 뇌에 염증이 생겨 문제가 발생하는데, GLP-1이 치매 위험을 낮춘다는 결과가 있다. GLP-1 RA인 Liraglutide 관련 LEADER, Semaglutide의 SUSTAIN-6, PIONEER-6 연구 결과에서 3년 추적 관찰 후에 치매 발생 정도를 확인했다. 치매 관련 위험비는 GLP-1 RA군에서 53% 낮은 것을 발견했다. 다른 연구에서도 GLP-1 RA는 혈관과 뇌 염증에 효과가 있다는 결과가 쌓이고 있다. Novo Nordisk는 Semaglutide 14mg에 대해 알츠하이머 초기 환자 대상 임상 3상을 진행하고 있으며, 2025년에 1차 결과가 발표될 예정이다(EVOKE 연구). • 중독: 최근 Semaglutide에 대해 의사와 환자들의 알코올 및 흡연 중독 치료 효과 사례가 보고되고 있다. 오클라호마주립대 연구소에서는 Novo Nordisk의 지원을 받아 Semaglutide 실사용 데이터를 기반으로 알코올 중독 치료 임상 2상(STAR-T)를 진행하고 있다.  후속 비만/당뇨 파이프라인의 개발 • 플랫폼 다변화: 기존 펩타이드 제형에서 항체 기반 또는 합성의약품 기반으로 개발이 확대되고 있다. GLP-1 펩타이드 제형의 대표 제품인 Rybelsus는 Semaglutide 용량 25, 50mg으로 기존 주사제형 대비 최소 10배 이상의 용량을 필요로 한다. 효율적인 생산을 위해 펩타이드 합성이 아닌 저비용으로 대량 생산이 가능한 합성의약품으로 대체하기 위한 시도가 이루어지고 있다. Pfizer는 경구용 1일 1 투약 가능한 non-Peptide GLP-1 RA lotiglipron(임상 1/2상)에 대해 2023년 6월 안전성 문제로 임상을 중단했으며, 1일 2회 복용이 필요한 non-Peptide GLP-1 RA danuglipron(임상 2상) 역시 2023년 12월 임상을 중단했다. Eli Lilly도 non-Peptide GLP-1 경구 치료제인 Orforglipron(LY3502970)에 대해 임상 3상을 진행하고 있으며, 2025년 두 건의 임상 3상 결과가 발표될 예정이다.  • 반감기 개선: 주 1회 제형을 넘어서 월 1회 제형 개발도 이루어지고 있다. GLP-1 RA를 1일 제형에서 1주 제형으로 반감기가 긴 펩타이드를 얻기 위해 Cmax(약물 투여 후 최고 혈중 농도)에 늦게 도달 (Tmax, 최고 혈장 농도에 도달하는 시간)하는 Pharmacokinetics를 가진 펩타이드를 개발하기 시작했다. Semaglutide는 Lys에 18개의 탄소 지방산을 붙여서 혈중 알부민과 결합하여 반감기를 개선시켰다. Tirzepatide도 GLP-1/GIP 수용체를 동시에 활성화시킬 수 있는 Peptide 구조의 20번째 Lys에 20개의 탄소 지방산을 붙여서 반감기를 개선했다. 1주 제형에서 1개월 제형으로 반감기가 훨씬 긴 Peptide 치료제를 개발하려는 시도도 이루어지고 있다. Amgen의 AMG-133은 항체 기반으로 월 1회 주사 제형으로 임상 2상을 진행하고 있다. GIP의 수용체를 타겟하는 항체에 GLP-1 RA 펩타이드 두 가닥을 연결하여 GLP-1/GIP 이중 작용의 효과를 기대하고 있다. 항체의 일반적인 반감기는 30일 수준으로 GIP 수용체를 억제하는 항체 덕분에 긴 반감기를 가질 수 있다. 그 외에도 Peptide를 미세구체로 만들어 약효를 지속시킬 수 있다. 한달 제형으로 안정적인 Pharmacokinetics를 얻을 수 있다면, 기존의 Peptide 치료제에 미세구체 기술을 적용하여 편의성이 개선된 치료제를 개발할 수 있을 것이다.  • 근육량 감소: Semaglutide 투약은 근육을 감소시킨다. 임상에 참여한 140명의 환자는 68주 동안 지방이 23파운드가 감소했으며, 그와 동시에 근육도 15파운드가 감소했다. 근육이 감소하면 향후 약물 투약 중단 이후 요요 현상이 나타날 가능성이 매우 높다. 이를 예방하기 위해 GLP-1 RA와 운동/식이 요법을 병행하면서 근육 감소를 예방할 수 있으며, 운동기능 장애가 있는 사람을 위해서 GLP-1 RA와 근육 감소를 방지할 수 있는 약물과의 병용 요법 임상이 2024년부터 진행될 예정이다  GLP-1 RA에 대한 고민 • 자살 연관성: 미국과 유럽에서 GLP-1 RA와 자살 충동과의 잠재적 연관성을 조사하고 있는 가운데, 정부 지원을 받아 진행된 Rong Xu, Nora Volkow의 연구에 따르면 Semaglutide를 처방받은 53,000명과 다른 비만 치료제를 처방받은 사람들을 비교한 결과, Semaglutide를 투약받은 5.3개월 동안 0.11%는 자살 충동이 있었다고 보고되었으며, 다른 비만 치료제를 처방받은 사람의 자살 충동 비율은 0.43%로 Semaglutide 처방이 자살률을 증가시킨다는 우려는 다른 비만 치료제 대비해 제한적으로 볼 수 있다. 하지만 GLP-1 RA가 자살 충동을 유도하지 않는다는 결론을 내리기에는 추가적인 연구는 필요하다. 의사들은 GLP-1 RA를 투약받는 경우 급격한 호르몬 변화와 체중 감소로 인해 정신적으로 영향을 받을 수 있다며 처방 받는 환자들에게 지속적으로 경고하고 있다. • 요요 현상: 2024년 1월 Eli Lilly의 Tirzepatide 관련 임상 3상 SURMOUNT-4에 대해 발표된 내용을 살펴보자. 36주간 Tirzepatide를 투약한 비만 또는 과체중인 사람은 평균적으로 20.9% 체중이 감소했다. 36주부터 Tirzepatide를 중단한 Placebo 군은 14% 체중이 증가했으나, Tirzepatide를 지속 투여 받은 실험군은 추가적으로 5.5% 체중이 줄어들었다. Tirzepatide의 중단으로 나타난 체중 증가는 다른 종류의 다이어트 시에도 나타나는 요요 현상으로 Tirzepatide와 같은 GLP-1 RA의 특이적은 부작용은 아니다. 체중을 유지하기 위해 반드시 값비싼 GLP-1 RA를 장기 투약해야 하는 것도 아니다. 다만 GLP-1 RA 투약은 비만을 완치시키는 치료제가 아니며, 요요 현상을 최대한 방지하기 위해서는 GLP-1 RA 투약에 의존하지 않고 전반적인 식생활 습관을 교정하는 것이 보다 중요하다. • 보험 보장 한계: 미국 보험사에서는 비만 치료제를 허영심(Vanity drugs) 마약이라고 부르면서 보험 적용을 꺼리고 있다. 미국 보험사에서는 비만을 질병으로 분류하기보다는 미용 관점으로 여전히 보고 있는 것이다. 여 전히 미국 일부 보험사는 Wegovy, Zepbound의 보험 적용을 거부하고 있으며, 다른 보험사에서는 보험 급여를 적용하되, BMI 지수가 30 이상(또는 BMI 27 이상이면서 운동 기능 장애가 있는 사람)인 환자에 한해 사전 심사 후 보험 보장을 받을 수 있도록 제한하면서, 환자에게 개인 부담금을 요구(Copay)하고 있다. 당뇨가 있는 비만 환자는 비만 치료제가 아닌 동일 성분의 당뇨 치료제로 보험 적용이 가능하기 때문에 Copay 부담이 거의 없다. 하지만 당뇨가 없는 비만 환자는 급여를 못 받으면 Copay 부담이 커질 수밖에 없다. 미국 공보험 Medicare Part D에서는 오직 당뇨 치료제 처방에 대해서만 급여를 보장하고 있다. 만약 Part D에서 Wegovy, Zepbound에 급여 적용을 해준다면 Part D의 연간 의료 지출 비용을 넘어설 것으로 예측된다. 비만 치료제 급여 적용은 단기적으로 비용 관점에서의 접근이 아니라, 중장기적으로 비만 관련 만성질환에 대한 예방 및 관련 비용의 절감이라는 측면을 고려해야 한다. 비만 치료제의 처방으로 1) 미국 내 비만율이 낮아질 수 있는지, 2) 비만 관련 만성질환 발병률은 향후 어떻게 변화하는지 등에 대한 사회적/경제적 효과에 대한 데이터가 충분히 쌓이게 된 이후에 비만 치료제에 대한 적극적인 급여 적용이 이루어질 것으로 예상된다. • 급격한 체중 감소로 인한 부작용: Ozempic(Semaglutide) face는 급격한 체중 감소로 인한 안면 지방 감소로 인해 피부 처짐과 주름이 나타나는 경우를 일컫는 용어이다. 이를 보완하기 위한 face filler 시술 및 레이저 시술이 확대되고 있다.  비만 치료제 시장을 선점하는 글로벌 제약사: Eli Lilly, Novo Nordisk Eli Lilly: 비만/당뇨 외에 다양한 포트폴리오 보유 Eli Lilly: Eli Lilly의 2023년 매출액은 336.6억 달러(+17.9% y-y), 영업이익은 72.4억 달러(-12.5% y-y)로 전망된다(Bloomberg). Eli Lilly의 주요 제품인 Trulicity(당뇨 치료제), Taltz(염증치료제), Verzenio(유방암 치료제) 등이 매출 비중 50% 이상을 차지하고 있으며, Mounjaro(당뇨 치료제, Tirzepatide), Zepbound(비만 치료제, Tirzepatide), Jaypirca(혈액암 치료제), Omvoh(궤양성 대장염 치료제) 등의 신제품 매출이 가파르게 성장하고 있다. Eli Lilly는 비만/당뇨 외에도 자가면역 질환 치료제, 항암제 등 다양한 분야에서 신제품을 발매하면서 포트폴리오를 강화하고 있으며, 1Q24에는 알츠하이머 치료제 Donanemab에 대해 FDA 품목 허가 승인 모멘텀도 보유하고 있다. • Zepbound의 시장 전략: 지난 2년 동안 GLP-1 RA의 1주 제형으로 Wegovy의 선풍적 인기를 확인했다. Wegovy의 처방이 가파르게 확대되는 와중에 Eli Lilly은 후속 제품인 Zepbound에 대해 Wegovy보다 저렴한 가격 정책을 제시했다. 28일간 공급 기준 Zepbound의 List price는 1,060달러로 Wegovy 가격 대비 21.5% 저렴하게 발매를 결정했다. 저렴한 가격에 더해 GLP-1 RA 단일제 대비 우수한 효능과 근육량 감소 완화까지 감안하면 Zepbound의 성장이 기대된다. • Tirzepatide의 확장성: Tirzepatide는 폐쇄성 무호흡증, 심혈관 질환, 심부전, 이환율 및 사망률에 대해 임상 3상을 진행하고 있으며, 비알콜성 지방간염에 대해서는 임상 2상을 진행 중에 있다. • Tirzepatide 후속 라인업: 비만/당뇨 분야에서 Novo Nordisk에 대항할 수 있는 가장 경쟁적인 제품을 Eli Lilly가 보유하고 있다. Eli Lilly의 Tirzepatide는 GLP-1/GIP 이중 작용제로 GLP-1 RA 단일제보다 혈당 강하 효과 및 체중 감소 효과가 우수하다. Eli Lilly는 경구용 GLP-1 RA 제품 포트폴리오를 확보하여 임상을 진행하고 있으며, Tirzepatide보다 더 강력한 효능이 기대되는 GLP-1/GIP/GCG 삼중 작용제에 대해서도 임상 3상을 하고 있다. 그 외에도 Versanis로부터 Activin을 억제하는 기전의 Bimagrumab을 확보하여 근육 감소를 예방하는 병용 임상 2상도 진행하고 있다.  Novo Nordisk: GLP-1 RA의 강자 Novo Nordisk: Novo Nordisk의 2023년 매출액은 334.1억 달러(+33.4% y-y), 영업이익은 147.8억 달러로(+38.0% y-y) 전망된다(Bloomberg). Novo Nordisk의 주요 제품은 Ozempic(당뇨 치료제, Semaglutide), Wegovy(비만 치료제, Semaglutide), Rybelsus(경구 당뇨 치료제, Semaglutide) 등으로 매출의 50%를 차지한다. Wegovy는 2022년 발매 이후 주사 편의성(1주 제형), 우수한 체중 감소 효과로 인해 미국에서 처방이 급격히 증가했다. Wegovy 보험 급여는 BMI 지수 30 이상인 고도 비만 환자에게 보장이 가능하며, Wegovy 처방을 받기 어려우나, 제2형 당뇨를 가진 환자의 경우 Wegovy 대신 Ozempic 처방을 선호하여 Wegovy와 함께 Ozempic 처방도 늘어났다. Rybelsus는 2023년 1월 FDA로부터 제2형 당뇨 환자 대상 1차 치료제 승인 이후 의사들의 적극적인 처방 확대로 가파른 성장세가 이어지고 있다. 미국, 유럽 외에 아시아 지역에서도 Semaglutide 제품의 매출 성장이 기대된다. • Semaglutide의 확장성: Novo Nordisk는 semaglutide에 대해 비만/당뇨 치료 목적 외에도 추가적인 적응증 확장을 위해 다양한 임상을 진행하고 있다. 2023년 8월 Semaglutide의 SELECT 임상 3상 결과를 발표했다. 17,000명의 당뇨가 없는 비만 및 심혈관 질환 환자 대상 위약 대비 Semaglutide 투약시 심혈관 관련 이벤트(MACE)가 20% 감소한 효과를 발표했다. 연이어 Semaglutide에 대한 심혈관 질환, 심부전(HFpEF) 임상 3상에서도 긍정적인 임상 결과를 발표했다. 2024년에는 말초동맥질환(PAD) 임상 3상 결과, 2025년 비알콜성지방간염 및 알츠하이머 임상 3상 결과에 대해 발표할 예정이다. • Semaglutide 후속 라인업: 경쟁제품 Eli Lilly의 Tirzepatide가 출시되면서 Semaglutide의 라인업을 강화하고 있다. Amylin 유도체와 Semaglutide와의 복합제인 CagriSema에 대해 당뇨 및 비만 환자 대상 임상 3상을 진행하고 있으며, 그와는 별도로 Amylin과 GLP-1 수용체를 동시에 활성화할 수 있는 Amycretin 이중 작용제에 대해서도 임상 1상을 진행하고 있다. 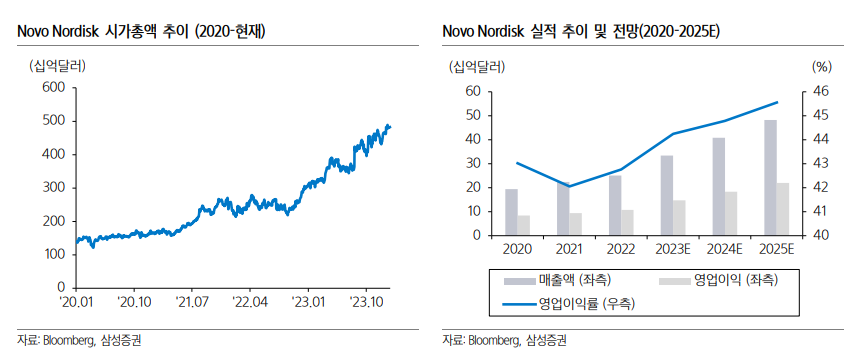 |
* 기술 거래 성공률 얼마나 될까? - 키움증권 (2023.01.23)
| CDA부터 최종 거래까지 기술 거래 성사 전환율 최근 3년간 우상향하면서, 지난 ‘23년 33%로 최대치 기록. 텀시트에서 최종 거래까지는 81%의 확률을 보임. 이는 기술 거래 기회가 줄어들고, 자금 조달이 어려워진 분위기 가운데 기술 거래 성사 가능성이 높은 파이프라인 위주로 물꼬가 트이고 있기 때문으로 해석. 국내 기술이전 논의 업체들의 선전을 기대. 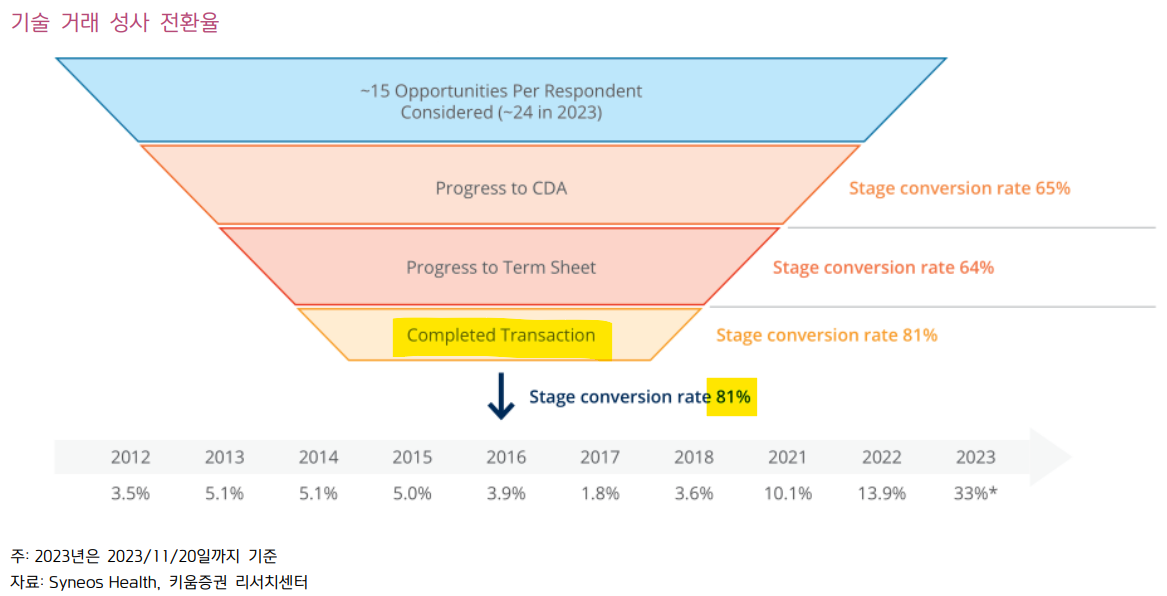 ◎ 최근 3년간 기술 거래 성사 전환율 상승세 >> Syneos Health Consulting의 설문조사에 따르면, CDA까지 65%, CDA에서 Term sheet 까지 64%, Term sheet에서 최종 거래까지 81%의 성사율 보였음. CDA부터 최종 거래까지의 거래 성사율이 최근 3년간 꾸준히 상승. 이는 기술 거래 기회가 줄어들 가운데 바이오텍 자금조달이 어려워지면서 기술 거래에 신중을 기하고, 기술 이전 성공 가능성이 높은 거래 기회에 선택과 집중 가능성이 높은 것으로 보임. >> 따라서 국내 기술 이전 논의 업체들의(특히, 텀시트 이상) 기술 거래 성과 기대 |
* [2024 유망바이오 톱10] 펩트론, 올해도 잇단 호재 대기...기업가치 상승예고⑩(끝) (2024.01.23)
https://www.edaily.co.kr/news/read?newsId=01082406638760672&mediaCodeNo=257&OutLnkChk=Y
| 지난해 기업가치가 급상승한 펩트론(087010)은 새해에도 고공행진을 이어갈지 투자자들의 관심이 집중되고 있다. 올해 기술수출 가능성과 매출 실현 등 호재를 발판으로 기업가치가 큰 폭으로 오를 것이라는 게 업계의 중론이다. 특히 기술수출의 경우 현실화되면 1조원 이상의 ‘빅딜’이 성사될 수 있을 것으로 전망된다. 2023년 주가 3배 넘게 상승...당뇨·비만치료제 기대감 16일 업계에 따르면 지난해 초(1월 2일 기준) 7720원에서 시작한 펩트론의 주가는 등락을 거듭해 지난달 21일 종가 기준 3만 500원까지 올랐다. 무려 370.5%가 상승한 수치다. 글로벌 빅파마들과 기술수출 가능성이 제기되면서 얻은 결과다. 업계에서는 여전히 기업가치 상승 가능성을 높게 점치고 있다. 추가 기술수출 가능성, 안정적 성장 기반 마련 등을 근거로 든다. 실제 펩트론은 글로벌 제약사 A, B사 등과 1~2개월 지속형 당뇨·비만치료제에 대한 실사를 진행하고, 향후 협업을 위한 논의를 하고 있다. 긍정적인 내용이 오가고 있는 것으로 알려졌으며, 올해 상반기 결과가 나올 것으로 예측된다. 글로벌 제약사가 펩트론에 관심을 보이는 것은 당뇨·비만치료제 ‘PT403’과 ‘PT404’ 때문이다. 각각 세마글루타이드와 GLP-1/GIP 이중 수용체에 기반한 1개월 이상 지속 서방형 제제다. 세계 당뇨·비만치료제 시장은 이 두 작용제를 중심으로 빠르게 성장하고 있다. 펩트론 제품은 여기에 지속성 약물 전달 기술인 스마트데포(SmartDepot) 기술을 적용한 게 특징이다. 업계에서는 PT403과 PT404가 기존 제품 대비(주 1회 지속형 주사제) 높은 경쟁력을 보일 것으로 분석한다. 세미글루타이드와 GLP-1/GIP 이중 수용체의 효과는 유지하면서, 지속시간은 최소 4배 이상 늘린 제품이기 때문이다. 업계에서는 펩트론이 PT403과 PT404로 1조원대 이상 규모로 기술수출을 성사할 수 있을 것으로 내다본다. 의약품시장조사업체 이벨류에이트파마에 따르면 글로벌 비만치료제 시장만 따져도 2022년 28억 달러(약 3조 7000억원)에서 2028년 167억 달러(약 22조원)로 커진다. 당뇨치료제까지 포함하면 관련 시장은 2028년 100조원을 넘어선다. 탄탄한 파이프라인으로 리스크 분산 펩트론은 탄탄한 파이프라인을 바탕으로 신약개발 실패에 대한 위험 부담도 최소화하고 있다. 펩트론은 최근 ‘루프원’(PT105)에 대해 LG화학(051910)과 국내 판권 계약을 체결했다. 루프원은 류프로렐린 제제의 1개월 지속형 전립선암, 성조숙증 치료제이다. 앞서 펩트론은 충북도와 200억원 규모의 루프원 생산시설 투자협약도 체결했다. 루프원은 글로벌 제약사 다케다의 류프로렐린 성분을 활용한 오리지널 제품(원제품) ‘루프린’의 제네릭(복제약)이다. 루프린은 1989년 출시 후 30년이 넘도록 세계 시장 점유율 1위를 기록하고 있는 대표적인 블록버스터 의약품이다. 펩트론은 루프린과 루프원의 약물동력학(PK)을 세계 최초로, 생물학적 동등성(BE)을 국내 최초로 각각 확보한 바 있다. 업계에서는 PT105가 국내외 1개월 지속형 전립선암 치료제 시장에 ‘게임체인저’가 될 수 있을 것으로 보고 있다. 업계에 따르면 지난해 국내 루프린 1개월 제형 시장은 600억원(오리지날 150억원+제네릭 450억원) 규모다. 글로벌 루프린 시장은 약 2조 7000억원으로 추정된다. 펩트론은 올해 루프원을 바탕으로 매출 반전도 이룰 수 있을 것으로 예상된다. 바이오 소재 등의 판매로 펩트론은 최근 3년간 60억원 내외의 연매출액을 냈다. 하지만 연구개발(R&D)에 공격적 투자 등으로 같은 기간 연 150억원 내외의 영업이익 적자도 이어지고 있다. 이 같은 격차는 올해부터 꾸준히 완화될 것으로 관측된다. 업계 관계자는 “루프원은 펩트론의 스마트데포 기술로 개발해 자체 생산하는 첫 상업화 제품이다”라며 “약물동력학과 생물학적 동등성 등을 확보하면서 글로벌 진출도 기대된다”고 전했다. 신규 기술수출 논의도 활발 펩트론은 다양한 신약에 적용 가능한 스마트데포의 추가 기술수출 논의와 협업에 더욱 힘쓸 계획이다. 실제 펩트론은 최근 미국에서 개최된 ‘JP모건 헬스케어 컨퍼런스와 바이오텍 쇼케이스 2024’에 참석해 이 같은 가능성을 높였다. 이 자리에서 글로벌 기업들은 펩트론의 약효 효과 기간 확대와 제형 변경 기술에 대해 큰 관심을 보인 것으로 알려졌다. 스마트데포의 경우 위탁개발생산(CDMO) 사업화 가능성을 높게 평가하고 있다. 스마트데포를 적용하면 일주일 정도 약효를 유지하는 제품도 수개월까지 늘릴 수 있기 때문이다. 더불어 펩트론은 약물 제형을 변경하는 원천기술도 보유하고 있다. 가령 정맥주사(IV)로 투여하는 제형의 약물을 근육주사(IM), 피하주사(SC) 제형 바꾸는 식이다. 펩트론 관계자는 “이번 행사에서 여러 글로벌 기업들이 스마트데포 등 우리의 원천기술에 대해 큰 관심을 보여 추가적인 논의를 하고 있다”며 “비만치료제뿐만 아니라 알츠하이머병 등 다양한 부문에서 위험부담 없이 적용이 가능하다는 게 특장점으로 여겨지고 있다”고 강조했다. |
* [JPM 2024] 세계 흔든 살 빼는 약 회사CEO의 경고 “먹는 비만치료제 부작용 해결 어렵다” (2024.01.10)
https://n.news.naver.com/mnews/article/366/0000961315?sid=101
| 9일(현지 시각) JP모건 헬스케어 콘퍼런스 발표 “위고비 투여 기간, 훨씬 길어질 것” “GLP-1 치료제 생산 능력 늘리고 있어” 덴마크 제약사 노보노디스크의 라스 푸르에가드 예르겐센 최고경영자(CEO)는 “최근 여러 제약사가 개발 중인 차세대 먹는 비만 치료제의 안전을 장담할 수 없다”고 말했다. 예르겐센 CEO는 9일(현지 시각) 오전 미국 샌프란시스코에서 열리는 세계 최대 바이오 제약 투자행사인 JP모건 헬스케어 콘퍼런스의 메인 무대에 올라 최근 여러 제약사가 개발하고 있는 먹는 비만약에 대해 이렇게 평가했다. 노보노디스크는 지난해 전 세계에서 열풍을 일으킨 GLP-1 유사체 기반 비만 치료제 ‘위고비(당뇨병 치료제 오젬픽)’를 개발했다. 이 회사의 시가총액은 8일 기준 4752억 달러(약 626조원)로 한 해 동안 57.3% 이상 급증했다. 이는 덴마크 국내총생산(GDP)인 4060억달러를 뛰어넘는 수치다. 예르겐센 CEO는 지난해 영국 파이낸셜타임스(FT)가 ‘올해의 인물’로 선정하기도 했다. 예르겐센 CEO는 32년 전 노보노디스크에 입사한 ‘노보맨’이다. GLP-1에 대한 과학적 개념도 아직 없던 초창기에 GLP-1기반 치료제에 베팅을 하며 오랜 시간을 보냈다. 예르겐센은 CEO로 취임한 직후 1만7000여 명 규모의 비만 치료제 대규모 임상시험을 결정했다. 이날 발표장은 노보노디스크에 대한 최근의 관심을 반영한 듯 많은 참석자로 북적였다. 행사장에 마련된 800석 규모의 좌석이 꽉 찬 것은 물론이고, 서서 발표를 듣는 사람도 보였다. GLP-1계열의 비만 치료제는 애초 당뇨병 치료제로 개발됐다. 혈당이 떨어지면 췌장이 인슐린 생산을 늘리는 호르몬을 활용해서 위에서 장으로 음식물이 넘어가는 시간이 늦춰지면서 식욕을 조절한다. 노보노디스를 비롯해 최근 화이자, 일라이릴리, 암젠 등 글로벌 제약사들도 GLP-1 기반의 비만치료제 개발이 뛰어들고 있다. 현재까지 허가된 GLP-1 치료제는 모두 주사제 방식이다. 하지만 최근 제약사들은 먹는 방식 치료제를 개발하고 있다. 예르겐센 CEO는 “최근 비만치료제 시장에서 일고 있는 경쟁을 환영한다”며 “하지만 먹는 방식의 GLP-1 치료제의 부작용에 문제가 있다”고 경고했다. 예르겐센 CEO는 ”위고비(성분명 세마글루타이드)는 큰 분자인 펩타이드 방식의 약으로, 오랜 처방으로 안전성이 입증됐다”며 “반면 다른 제약사들이 개발하고 있는 먹는 GLP-1은 모두 소분자로 구성돼 안전을 장담할 수 없다”고 했다. 주사로 맞는 GLP-1은 췌장에만 영향을 미치지만 소분자 GLP-1 의약품은 췌장을 넘어 신체 다른 쪽에 영향 미쳐 부작용을 일으킬 수도 있다는 것이다. 일례로 먹는 GLP-1을 개발하던 미국의 화이자는 임상 시험에서 일부 대상자의 간 효소가 상승하는 것을 확인하고 시험을 중단했다. 예르겐센 CEO는 “먹는 방식의 GLP-1 치료제는 안전문제가 있어서 규제 당국이 도입하고 싶은 생각을 하지 못할 것 같다”고 말했다. 노보노디스크도 위고비의 먹는 약 버전을 개발하고 있다. 예르겐센 CEO는 “세마글루타이드는 소분자가 아닌 펩타이드 형태이고, 이 약은 현재 당뇨병 환자 용으로 개발돼 안전성이 확인됐다”고 했다. 이어 “다만 먹는 약은 먹는 체내에 흡수되고 순환될 만큼 충분한 양이 필요하다”며 “약물 용량 증량에 따른 부작용 문제를 잘 살펴봐야 한다”고 말했다. 최근 연구에서 GLP-1 계열의 비만약 투약을 중단하면 체중이 다시 늘어나는 ‘요요현상’이 나타나는 것으로 확인되면서 환자들의 우려가 커지는 것도 사실이다. 예르겐센 CEO는 “위고비를 맞은 환자들은 효과를 유지하기 위해 투약을 계속하는 것으로 보인다”며 “비만 치료제를 투약하는 기간이 예상보다 길어질 것으로 보인다”고 전망했다. 로이터에 따르면 지난달 발표된 미국의 의료 기록과 보험 청구 데이터를 보면 2021년에서 2022년까지 위고비를 처방 받은 환자의 40%가 1년 뒤에도 여전히 약을 투약하는 것으로 나타났다. 예르겐센 CEO는 최근 나타나는 GLP-1 의약품의 공급 부족 상황과 관련해 “생산 능력을 몇 배로 늘리고 있다”고 말했다. 약이 너무 비싸다는 지적에 대해서는 “비만과 싸우는 사회적 비용과 비교하면 경제적으로 본다”며 “다른 나라에 비해 의료비가 비싼 미국의 경우에는 이 같은 공식이 작동한다”고 말했다. 예르겐센 CEO는 “미국에서 비만 환자에 들어가는 의료비는 GLP-1 치료제보다 훨씬 더 많다”며 “이건 하나의 수학에 해당한다”고 말했다. |
* [블로그] 2023년도 결산 - 리아멍거 (2023.12.22)
https://m.blog.naver.com/PostView.naver?blogId=riamunger&logNo=223300842216&navType=by

* 'JPM헬스케어 참석' 펩트론, 지속형 비만 치료제 L/O 딜 임박했나 (2023.12.21)
http://www.hitnews.co.kr/news/articleView.html?idxno=50862
| 글로벌 제약사, 펩트론 지속형 비만·당뇨치료제 기술도입 검토중 업계 "L/O 업프론트 500억 이상… 전체 계약 규모 2조~3조 거론" 글로벌 빅파마 중 한 곳이 펩트론의 지속형 비만·당뇨 치료제 도입을 검토하고 있는 것으로 알려졌다. 이미 해당 글로벌 제약사와 물질이전계약(MTA)과 실사(Due Diligence)가 이뤄졌던 만큼, 계약 조건 협의가 순항할 경우 이르면 내년 1분기 중에는 기술이전(라이선스 아웃·L/O) 계약이 가능해질 것이라는 전망도 나오고 있다. 21일 투자업계에 따르면 펩트론은 파트너사 중 한 곳인 글로벌 제약사의 초청으로 내년 1월 초 개최되는 'JP모건 헬스케어 콘퍼런스'의 본 행사에 참석한다. 콘퍼런스 본 행사에는 JP모건 측의 공식 파트너가 초청한 기업만이 참여할 수 있다. 이에 해당 행사에선 펩트론과 이 글로벌 제약사 간에 텀시트(Term Sheet) 조건 협의 등 구체적인 기술이전 논의가 이뤄질 수 있을 것으로 업계는 관측하고 있다. 펩트론의 이번 JP모건 헬스케어 콘퍼런스 행사 초청은 어느 정도 예고된 바 있는 움직임이라는 게 회사 안팎의 시각이다. 펩트론 IR 자료에 따르면 세마글루타이드와 터제파제이드에 대한 MTA가 진행됐다. 통상 MTA는 실사의 일환으로 진행되는 계약이다. 기술 도입을 원하는 측은 MTA를 통해 잠재적인 기술이전 대상 물질을 직접 수령해 내부적인 점검 및 시험 절차를 거친다. 이어 펩트론은 최근 글로벌 제약사가 'PT404'에 대한 독점 계약을 요구하는 상황임을 밝힌 바 있다. 회사 측이 밝힌 내용이 사실이라면 MTA를 포함한 실사가 긍정적인 방향으로 진행되고 있음을 유추할 수 있는 대목이다. 이후 기술이전 본계약까지 남은 절차는 텀시트 체결이다. 과거 이뤄진 JP모건 콘퍼런스 본 행사에서 논의되거나 체결된 텀시트 및 본계약이 적지 않다는 점을 고려하면, 해당 글로벌 제약사는 실사 단계의 마무리로 펩트론을 직접 대면해 콘퍼런스 현장에서 텀시트 조건을 제시하거나 체결을 권할 수도 있다. 펩트론 측은 여태까지 PT404를 검토하는 글로벌 제약사의 이름을 밝힌 바 없다. 하지만 PT404의 주성분과 이번 콘퍼런스 참여 등 정황을 종합하면 검토 주체는 글로벌 빅파마 중 한 곳임을 짐작할 수 있다. PT404는 비만 치료제 '젭바운드'의 주성분인 터제파타이드를 활용한 일종의 바이오베터다. 젭바운드는 주 1회 투여가 필요한 반면, PT404는 월 1회 혹은 2개월당 1회 투여가 가능하도록 개발되고 있다. 바이오베터는 많은 경우 오리지널 개발사의 관심을 받게 된다. 오리지널 약물이 점유한 시장을 굳히거나, 특허 만료 후의 에버그리닝(Evergreening) 전략으로 활용될 수 있기 때문이다. 키트루다를 피하주사(SC)제 형태의 바이오베터로 개발한 알테오젠이 키트루다의 원주인인 미국 머크(MSD)의 러브콜을 받는 것도 같은 맥락상에 있다. 따라서 젭바운드의 바이오베터인 PT404에 대해 현재 가장 활발히 협의를 진행하는 곳은 원주인일 가능성이 큰 상황이다. 투자업계에서는 해당 글로벌 L/O 딜과 관련해 업프론트(Upfront)가 약 500억원 이상, 전체 계약 규모는 2조~3조원으로 거론되고 있다. 특히 한 자릿수 로열티(Royalty)도 논의되고 있는데, 소수 글로벌 빅파마 중심의 과점 체제인 비만 치료제 시장에서의 로열티 조항은 향후 매년 수천억원 이상의 로열티 발생을 의미하기 때문에 그 기대감은 더욱 크다. 이번 JP모건 콘퍼런스에서 해당 글로벌 제약사와 펩트론이 논의할 내용에는 생산 거점 이슈도 포함될 것으로 예상된다. 업계에 따르면 펩트론의 현재 PT404 생산능력(CAPA)은 글로벌 수요를 감당하기 어려워, 생산시설을 증축하거나 글로벌 제약사로 생산기술을 이전하는 방향을 고려해야 한다. 시설 증축으로 가닥이 잡힌다면 기술이전 계약과 별도로 위탁생산(CMO) 계약을 맺게 될 것으로 보이지만, 생산기술 이전으로 협의가 이뤄질 경우 기술이전 계약과 분리된 별도의 계약이 체결될 것으로 점쳐진다. |
* 펩트론, JPM 헬스케어 참가···비만치료제 外 새로운 빅딜 준비 (2023.12.20)
https://www.sisajournal-e.com/news/articleView.html?idxno=306353
| 펩트론, 내년 1월 8~11일 JP모건 헬스케어 컨퍼런스-바이오텍 쇼케이스 참석 지속형 약물 전달 플랫폼 '스마트데포' 내세워 기술이전, 전략적 파트너쉽 준비 펩트론이 내년 1월 8일부터 11일까지 개최되는 제42회 JP모건 헬스케어 컨퍼런스와 바이오텍 쇼케이스(Biotech Showcase) 2024에 참석해 글로벌 기업과 신규 기술이전 및 전략적 파트너쉽 관련 논의를 진행한다. 펩트론은 ‘스마트데포’ 플랫폼 기술을 내세워 다양한 기업과 비즈니스 미팅을 앞둔 가운데 글로벌 빅딜 기대감이 높아지고 있다. 20일 업계에 따르면 매년 1월 미국 샌프란시스코에서 개최되는 JP모건 헬스케어 컨퍼런스와 바이오텍 쇼케이스는 글로벌 제약·바이오 기업과 헬스케어 전문 투자자 등 15000명 이상이 참여하는 세계 최대 규모의 헬스케어 투자 및 파트너링 행사다. 다수의 국내 제약·바이오 기업들이 참가 소식을 전하며 관심이 커지고 있다. 이중 펩트론은 내달 열리는 바이오텍 쇼케이스에서 글로벌 제약사들과 회사의 핵심 플랫폼 기술인 ‘스마트데포(Smart Depot)’에 대한 CDMO(위탁개발생산) 사업화와 기술이전 관련 미팅을 가질 예정이다. 스마트데포는 약물의 효과 기간을 최소 일주일~수개월 지속시켜주는 펩트론의 원천 기술이다. 혈중 내 약물 방출을 조절해 정해진 기간 동안 약효가 지속되는 방식이다. 스마트데포 플랫폼 기술을 약물에 적용하면 기술적 한계로 인식되는 주 1회 투약보다 투여 주기를 늘릴 수 있다. 올해 글로벌 제약사 노보노디스크와 일라이릴리가 각각 주 1회 투여 방식의 비만치료제 ‘위고비’와 ‘젭바운드’를 출시하며 세간의 이목이 쏠린 바 있다. 하루 1회 주사 투여해야 하는 기존 비만치료제보다 투여 주기를 늘려 환자 편의성을 개선함으로써 시장에서 돌풍을 일으켰다. 전 세계 품귀 현상이 벌어지는 등 지속형 제제의 폭발적 인기는 지속형 약물 전달 플랫폼에 관심과 수요로 이어지고 있다. 펩트론은 이 같은 글로벌 트렌드에 맞춰 지속형 약물 전달 플랫폼 스마트데포 기술을 토대로 추가 기술이전에 나선다는 목표다. 그 시작점을 내달 열리는 JP모건 헬스케어 컨퍼런스와 바이오텍 쇼케이스로 타깃, 점진적으로 글로벌 기업과 기술이전 미팅을 늘리겠다는 것이 회사 측 설명이다. 펩트론의 신약 파이프라인 중 스마트데포 플랫폼 기술이 적용된 1개월 지속형 당뇨·비만 치료제 ‘PT403’은 글로벌 제약사와 기술이전 논의가 순차적으로 진행되고 있다.  펩트론이 내달 바이오텍 쇼케이스에서 진행할 스마트데포 플랫폼 기술 관련 글로벌 기술이전 미팅은 크게 두 가지 전략으로 구분된다. 먼저 고객사의 약물에 스마트데포 기술을 적용해 체내 지속 기간을 늘려주는 서비스에 대한 세일즈다. 쉽게 말해, 고객사가 요구하는 약물 지속 효과를 일주일에서 한 달로 늘리는 작업이라고 볼 수 있다. 또 약물 제형을 변경하는 기술에 대한 비즈니스 미팅도 가질 예정이다. 해당 사업은 정맥주사(IV)로 투여하는 제형의 약물을 근육주사(IM), 피하주사(SC) 제형으로 바꾸는 작업이다. 주사 제형 글로벌 트렌드는 정맥주사 형태의 기존 의약품을 환자가 스스로 투여할 수 있는 피하주사로 바꾸거나, 정맥주사보다 투여하는 약물 양이 적고 피하주사보다 효과 발현이 빠른 근육주사로 바꾸는 흐름이 대세다. IV 주사제형의 단점을 개선하되 환자의 투여 편의성을 극대화해 시장성을 높일 수 있어서다. 앞서 회사는 2003년 대웅제약과 1개월 지속형 전립선암 치료제, 2011년 유한양행과 1주/2주 지속형 당뇨병 치료제에 대한 기술이전 계약을 체결한 바 있다. 두 파이프라인 모두 회사의 스마트데포 기술이 적용된 약물이라는 특징이 있다. 지난달엔 LG화학과 전립선암 및 성조숙증 치료제 ‘루프린’의 제네릭 약물인 ‘루프원(PT105)’에 대한 국내 판권 계약을 체결했다. 펩트론 관계자는 “회사의 스마트데포 플랫폼 기술은 고객사 니즈에 맞춤형으로 대응할 수 있다는 것이 장점”이라며 “비만치료제, ADC, 성장호르몬제제, 알츠하이머병 등 장기 지속형 주사제형 수요가 있는 분야에 다양하게 접목할 수 있어 추가 상업 기회를 모색 중”이라고 말했다. |
* 비만치료제 위고비 제2형 당뇨병 환자 대장암 발병 44% 낮아 (2023.12.10)
https://www.pinpointnews.co.kr/news/articleView.html?idxno=231111
| 비만치료제로 알려진 위고비, 오젬픽 등이 제2형 당뇨병 환자의 대장암 위험을 줄일 수 있는 것으로 나타났다. 더메신저에 따르면 8일(현지시간) 미국 클리브랜드 케이스웨스턴리저브대학교(Case Western Reserve University)가 '자마 온콜로지(JAMA oncology)'에 발표한 연구에 따르면 위고비와 오젬픽 등을 복용한 환자의 대장암 발병 가능성이 낮게 나타났다. 연구 결과에 따르면 위고비와 오젬픽을 복용한 환자 2만2572명과 인슐린을 복용한 다른 환자 2만2572명을 비교한 결과 두 약물을 복용한 환자는 대장암 발병 가능성이 44% 낮았다. 연구진은 또 다른 일반적인 당뇨병 치료제 메트포르민과 유사한 비교를 실시했다. GLP-1 계열 약물을 복용한 환자 1만8518명과 메트포르민을 복용한 환자 1만8518명을 비교했을 때, GLP-1 계열을 복용한 환자는 대장암 발병 가능성이 25% 낮았다. 노보노디스크 위고비와 일라이릴리의 젭바운드는 GLP-1 관련 기술을 활용한 비만치료제로 공급이 부족할 정도로 인기를 끌고 있다. 이 약물들은 심장 건강에 도움이 되고 뇌졸중과 심장마비로 인한 사망 위험을 줄일 수 있다는 증거도 발표됐다. 연구 책임자 나단 버거 박사는 "이 결과는 GLP-1 RA가 메트포르민이나 인슐린과 같은 인기 있는 항당뇨병 약물보다 대장암 발병 예방에 훨씬 효과적이라는 것을 보여준다"라고 말했다. 노보노디스크와 일라이릴리의 비만치료제가 미국 식품의약국(FDA)으로부터 승인을 받으면서 인기를 끌자 로슈 등 세계 대형 제약사들도 개발에 속도를 내고 있는 모양새다. 비만치료제 위고비는 2024년 2월 일본에 출시될 예정이며 한국은 상반기에 출시될 것으로 알려졌다. 한국거래소에서 비만치료제 위고비 관련주는 당뇨·비만 치료제를 개발하고 있는 펩트론, 혈당 측정기 등을 생산하는 아이센스, 인벤티지랩, 동아에스티, 대봉엘에스 등이 거론된다. 이밖에 한국비엔씨, 큐라티스, 종근당, 애니젠, 유한양행, 일동제약, 한미약품, HLB제약, 셀트리온제약 등은 비만치료제 관련주로 거론된다. |
* "이럴 줄은"…'비만치료제 개발' 화이자, 돌연 임상중단 선언 (2023.12.01)
https://n.news.naver.com/article/015/0004920836
| '비만치료제 개발' 화이자에 무슨 일이 "살 빠져도 부작용 심해" 화이자, 돌연 임상 중단 시험 참여자 73% '메스꺼움 호소' 47% '구토증'· 25% '설사병' 위장 장애 등 부작용에 시험자 대다수 약물 복용 중단 비만치료제 개발 경쟁에 뒤늦게 합류한 화이자가 돌연 임상시험 중단을 선언했다. 중간 임상 단계에서 실험 참여자들에게 위장 통증 등 부작용이 나타나서다. 경구용 신약으로 역전을 노리던 화이자의 전망이 암울하다는 평가가 나온다. 1일(현지시간) CNBC에 따르면 화이자는 경구용 비만치료제 '다누글리폰'에 대한 3상 임상시험을 시행하지 않을 예정이며, 이에 대한 개발도 중단한다고 밝혔다. 2상 임상시험을 치르면서 부작용을 호소하는 참가자들이 늘어나서다. 다누글리폰은 하루 2회 복용하는 경구용 비만치료제다. 화이자 관계자는 CNBC에 "현재로선 다누글리폰 3상 임상시험을 계속 진행할 계획이 없다"고 말했다. 화이자는 제2형 당뇨병 병력이 없는 성인 약 600여명을 대상으로 다누글리폰 2상 임상시험을 진행했다. 이 시험에서는 40~200㎎ 등 복용량을 조절하며 26~32주간 임상 시험을 시행했다. 앞서 화이자가 공개한 다누글리폰의 중간단계 실험에서는 12주간 200㎎을 복용한 당뇨병 환자가 체중 5.8%를 감량한 것으로 나타났다. 다누글리폰은 체중 감소에 대한 효능을 입증했다. 모든 용량을 테스트한 결과 '유의미한 체중 감소'가 나타났다. 시험 26주째에 실험자들의 체중이 이전보다 4.8~9.4% 줄었고, 32주째에는 6.9~11.7% 감소했다. 일반적으로 10% 안팎의 체중 감소가 이뤄져야 비만 치료제의 효과가 있다고 판단한다. 다만 신약에 대한 부작용도 컸다. 시험 참여자 중 73%는 메스꺼움을 호소했고, 47%는 구토증을 겪었다. 25%는 시험 기간 동안 설사병을 앓았다. 위장 장애 등 부작용이 나타나면서 시험자 대다수가 약물 복용을 중단했다. 시험 참가자가 증가하게 되자 화이자는 임상 시험을 돌연 중단한 것으로 풀이된다. 다누글리폰 개발이 일시 중단되자 화이자는 신약 개발 경로를 바꿀 예정이다. 1일 1회 복용하는 신약 개발에 속도를 올리겠다는 입장이다. 내년 중순께 1일 1회 복용하는 신약에 대한 2상 임상시험을 진행할 계획이다. 다만 화이자는 지난 6월 1일 1회 복용하는 실험 약을 개발했지만, 실험자들의 간 효소 수치가 높아져 폐기한 바 있다. 화이자의 비만치료제 개발이 난항을 겪자 경쟁에서 뒤처질 것이란 우려가 커졌다. 당초 앨버트 볼라 화이자 최고경영자(CEO)는 지난 1월 장내 호르몬을 모방해 식욕을 억제하는 비만·당뇨 치료제인 GLP-1 시장이 900억 달러(약 119조원)로 성장할 수 있다고 전망하면서 "경구용 치료제를 개발해 이 부문에서 100억 달러를 확보한다는 계획이다"라고 밝혔다. 하지만 이번 임상이 실패하며 비관론만 확산하는 모습이다. CNBC는 "제약업계에선 이미 일라이릴리의 경구용 비만 치료제가 화이자 신약보다 부작용이 덜하다고 평가하고 있다"며 "1일 1회 복용하는 신약의 2상 임상 결과가 나오기 전까지 화이자의 입지는 위태로울 것"이라고 평가했다. 비만치료제 선두 주자인 일라이 릴리와 노보노디스크는 경구용 비만치료제 개발 속도를 올리고 있다. 일라이릴리는 지난 6월 미만 또는 과체중 환자가 비만치료제 오르포글리프론을 36주 간 하루에 한 번 45㎎ 복용한 결과 14.7%의 체중 감량 효과를 거뒀다는 2상 임상실험 결과를 공개했다. 같은달 노보노디스크 역시 먹는 비만치료제 세마글루타이드의 3상 실험 결과를 공개했다. 과체중 또는 비만 환자가 하루에 한 번 50㎎을 복용한 결과 68주 후 15.1%의 체중을 감량했다. |
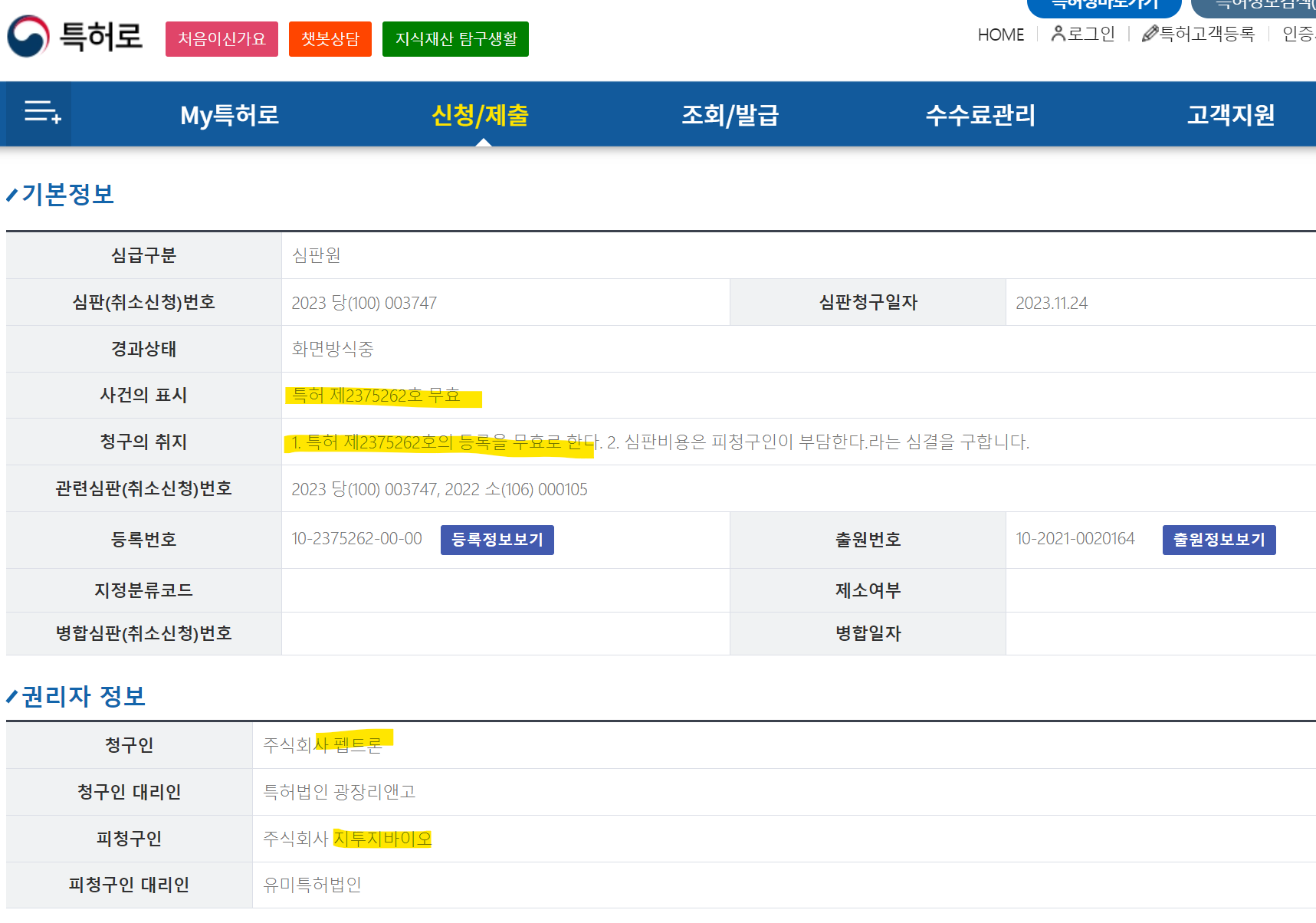
* 펩트론에서 지투지바이오에 특허 무효 소송 제기
* 2024년 제약/바이오 연간전망 - 승리를 향한 빌드업 - 키움증권 (2023.11.22)
| < 일부 발췌 > 좁아지는 신약의 문. 여전히 높은 눈높이 고금리 장기화, 높은 신약 기대치, 낮은 성공확률로 거듭된 실망 고금리 장기화가 이어지고, 과거와 같은 제로 금리 또는 1% 수준의 저금리의 유동성을 기대하기 어렵다. 게다가 미국의 약가인하 정책 규제, 어려운 자금 조달 환경 속에서 오랜 시간 성과가 나지 않는 고위험 고수익 혁신 신약 개발사에 대한 투자심리는 과거 바이오 버블 시기와 다르다. 딜레마는 시장은 펀더멘털이 안정적인(실적, 빅파마 기술이전, 풍부한 현금) 기업을 선호하면서도, 기업 가치를 올려줄 수 있는 R&D 파이프라인을 여전히 선호한다. 다만, 혁신 신약 개발은 과거 대비 쉽지 않은 상황이다. 빅파마의 신약개발 기간을 살펴보면, 엄격해진 미국 규제 당국에 임상 개발부터 승인까지의 기간이 과거(‘13~’17년)보다 약 1년 가량 늘어났다. 게다가 FDA의 임상 중단 내린 건 수가 ‘21~’22년 높았고, 신약의 허가보완요청서류(CRL) 비중도 ‘18년 12% 대비 ‘22년 31%로 증가하였다.  이러한 상황에서는 비교적 안정적인 신약 개발 플랫폼이 선호되는데, 약물 전달 시스템(DDS) 기반 플랫폼은 이미 성공한 신약의 제형을 변경하는 것으로 성공확률이 높고, 2상 생략이 가능해 상용화 시기 단축도 가능하다는 장점이 있다. 제형 변경 임상은 기존 원료(API)를 변경하지 않아 2상을 생략할 수 있고, 비교적 수월한 규제를 적용 받는다. 일반적으로 신약개발에 15년 이상의 시간이 소요되나, 약물 전달 시스템(DDS)를 활용한 제형 변경의 경우 4~5년 소요로 기존 신약 개발 기간의 1/3 수준으로 신속한 출시가 가능하다. 셀트리온의 짐팬트라가 미국 FDA로부터 신약으로 판매 허가를 획득하였는데, FDA가 허가 협의 단계부터 신약 허가 절차를 권고했으며 이를 위해 셀트리온은 두 개 신규 글로벌 3상을 수행했다. 또한, SC제형에 대한 특허 출원이 완료되어, 최대 2040년까지 특허 보호를 받을 수 있다. 약물 전달 시스템(DDS) 플랫폼을 활용한 신약 개발은 리스크를 줄이면서도 신약과 같은 파급효과를 낼 수 있는 것이다.  K-BIO 메가 버스터의 제형 변경을 노리다 면역항암제에 이어 GLP-1 비만 치료제까지 기술 수출 된다면, 또 한번의 레벨업 알테오젠이 지난 2020년 정맥주사를 피하주사로 변경하는 ALT-B4 플랫폼으로 다수의 품목에 대하여 총 4.7조 원에 달하는 기술 수출에 성공하면서, 당시 바이오텍 대장주로 우뚝섰다. 그 중 하나가 바로 면역관문억제제인 머크의 키트루다로 추정되는데, 키트루다는 ‘22년 매출액이 무려 $21bn에 달하는 초대형 블록버스터 신약이다. 메가 글로벌 블록버스터 신약의(연 매출 $10bn 이상) 제형을 변경하는 플랫폼 계약을 맺었다는 점에서 의미가 있으며, 현재 비독점 계약이나 독점 계약으로 변경되어 매출 로열티를 받게 된다면 수익 창출 지속이 가능하다. 전세계 신약 시장에서 면역관문억제제 이후의 메가 히트 제품으로 꼽히는 것이 바로 요즘 높은 관심을 받고 있는 당뇨/비만 치료제 GLP-1 수용체이다. GLP-1 수용체는 일 1회에서 1주 1회로 편의성이 개선되고 있어, 경구용과 월1회 제형에 대한 수요가 있을 것으로 보인다. 제형 관련 포트폴리오 확보를 위해 글로벌 제약사가 국내 지속형 개발사와 기술 수출을 맺는다면 2010년대와 2020년대의 메가 히트 제품의 제형 변경을 모두 K-Bio에서 담당하게 되는 것이다. CMO와 바이오시밀러로 도약한 국내 헬스케어 산업이 약물 전달 시스템(DDS) 분야 강자로 떠오르길 기대한다 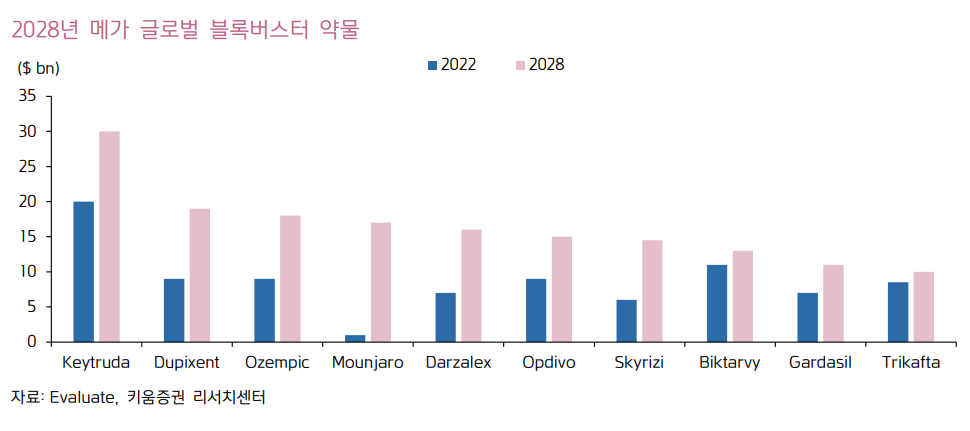 K-BIO가 강한 약물 전달 시스템 약물전달시스템(DDS)란? DDS의 정의 및 특징 약물전달기술은 필요한 양의 약물이 목표 부위에 효율적으로 전달될 수 있도록 약물 제형을 설계하는 기술이다. 치료 효능 강화, 부작용 감소, 환자 순응도 증진, 생체이용률 향상성 등 다양한 방법으로 치료 효과를 개선시킬 수 있는 제형을 설계하여 약물치료를 최적화한다. 약물전달시스템은 투여 경로에 따라 분류할 수 있는데 경구투여(먹는 약), 경피투여(바르거나, 붙임), 주사제, 폐 흡입, 눈과 점막 투여 등이 있다.  1952년 Spansule 서방형 기술 출현을 시작으로 저분자 약물의 투여 빈도가 줄어들고, 환자의 순응도가 향상되었다. 이러한 장기 지속 전달 기술은 정신질환, 통증 및 진행성 전립선암을 포함한 여러 질환의 치료 및 관리를 개선 시켜 상용 성공화의 핵심 성공 요인이 될 수 있다. 지난 ‘17년 플렉시온의 마이크로스피어 기술을 적용한 서방형주사제 골관절염 신약 질레타(Zilretta)가 FDA로부터 승인을 받았다. 일반적으로 사용되는 스테로이드제를 변형해 제조된 비마약성 의약품이다. 주로 고령환자에서 발생하는 퇴행성 관절염 환자들은 스테로이드가 당뇨 환자의 혈당을 상승시키는 단점으로 고령의 당뇨 환자들은 사용이 어려운데 반해, 질레타는 서서히 낮은 농도로 방출되어 혈당수치의 급격한 상승을 막아주고 위약군 대비 통증감소에 현저한 효과를 보여준 것으로 나타났다. Doxil 및 Abraxane는 나노 파티클에 초점을 맞춰 종양을 표적하여 전달하는 것으로 약물의 우수한 효능 개선 보다는 부작용을 감소시키고 반감기가 증가되었다. PEG(Polyethylene glycol)을 단백질에 결합하면 반감기가 증가하는데, 현재 약 20개의 PEG화 단백질 제제가 개발되었다. 특히, 만성 질환의 경우 환자 순응도가 낮아 연간 약 125,000명의 사망자가 발생하고 연간 약 1,000억 달러($100bn)의 의료 비용이 발생한다. 지속적인 약물 방출이 된다면 수년에 걸쳐 치료가 필요한 만성 질환이나 의료 서비스 접근이 제한적인 환경의 환자에게 중요하다. 현재 FDA 승인 받아 시판되는 지속성 의약품은 63개이다. 지난 50년 동안 중증 만성질환 및 감염성 질환 발생빈도 증가하였고, 지속형 주사제가 폭발적인 방출(burst release)을 최소화하는 등의 기술 발전으로 인해 약물 개발에 대한 수요도 증가하였다.  지속형 약물전달시스템 장기 약물투여하는 만성질환에 필요. 코로나 이후 고성장 전망 서방형(Sustained release) 또는 지속형(Long acting) 이란 투여횟수의 감소 또는 부작용을 줄이기 위하여 유효성분의 방출 속도, 방출 시간, 방출 부위를 조절한 제제를 뜻한다. 전세계 고령화 가속화로 만성질환 발병률 증가하며, 서방형 약물 전달 시스템에 대한 수요도 증가하고 있다. 지속형 약물전달의 장점으로는 다음과 같다. - 투여횟수 감소: 느린 용출을 나타내어 속방성제제 대비 투여횟수 감소 - 부작용 감소: 약물 방출을 조절하여 독성 농도 이하로 유지하여 부작용 감소 주사제의 경우 침습에 의한 감염 위험성 감소 - 순응도 증가: 투여 시기 놓치는 횟수 감소 주사바늘 크기 감소로 거부감 개선, 편의성 개선 - 의료비 감소: 환자 관리 비용 절감 - 특허 보호: 지속형 바이오베터(Long-acting)은 별도의 독자적인 특허로 보호 Research and Markets에 따르면 지속형 약물전달시스템의 시장은 ‘21년 $36.9bn에서 연 평균 약 8.53%씩 성장해 ‘27년 약 $60.4bn이 될 것으로 전망된다. 서방형 약물전달 시장은 코로나 팬데믹 경험으로 인해 오히려 수요가 높아지고 있어, ‘27년 코로나 팬데믹 이전보다 더 높은 성장률을 보일 것으로 예상된다. 투여방법별 지속형 약물전달 시장 점유율은 경구 제형(51%)을 제외하고는 장기지속형 주사제가 20%로 높았다.  장기 지속형 주사제의 매력은 높은 기술 장벽 대표적인 장기 지속형 주사제로 알려진 제품으로는 노보 노디스크의 위고비(1주 1회), 릴리의 젭바운드(1주 1회)가 있으며, 이 외에도 노바티스의 말단비대증 치료제 산도스타틴(Sandostatin LAR)과 얀센의 조현병 치료제 인베가(Invega Sustenna) 등이 있다. 장기 지속형 주사제는 항정신병 치료, 피임 및 호르몬 대체 요법, 당뇨 등과 같은 만성 질환에 수요가 높다. 조현병 치료제에서 경구용 약물이 차지하는 비중은 ‘09년 92%였으나, 1개월 주사제형 출시 후 ‘18년 장기 지속형 주사제 비중이 93%까지 증가한 바 있다 (3개월 지속형 포함). 노바티스의 산도스타틴은 ‘17년 특허만료에도 ‘16년 매출액 $1.6bn에서 ‘17년 $1.6bn으로 유지되었으며, 지난해인 ‘22년 매출액은 $1.2bn으로 점유율이 잘 유지되었다. 이에 대해 노바티스는 복잡한 제조 공정과 생산이 어려워 쉽게 제네릭 경쟁에 노출되지 않을 것이라고 자신한 바 있다. 지속형 주사제는 언뜻 쉬워 보이지만 기술적 장벽이 높다고 알려져 있다. 미립구 기반 약물은 연구 수준에서 소량의 제조가 가능하나, GMP를 갖춘 대량생산의 기술적 난이도가 높고, 약물 방출 조절에 실패하면 약동학(PK) 구현이 되지 않아 글로벌 제약사들조차 공정개발 실패로 개발을 중단하기도 한다.  당뇨/비만 등과 같은 만성질환 치료제 시장 성장으로 재차 주목 서방형/지속형 제제는 오랜기간 관리가 필요한 만성질환과 아이, 노인과 같이 순응도가 낮은 환자들에 대한 수요가 높다. 당뇨병치료제에서 비만치료제로 고성장 중인 GLP-1 작용제가 1일1회에서 1주1회 로 편의성 뿐만 아니라 효능도 개선되었다. Amgen이 GLP-1/GIP 이중 작용제의 한달 제형이 1상을 성공하여 현재 2상 중이며, 주요 다국적 제약사인 노보와 릴리 또한 한달 제형 및 경구제형 등 편의성 개선에 제품 포트폴리오를 강화할 것으로 예상된다. 이와 관련된 자세한 내용은 지난 2023.08.23일 발간된 <제약/바이오: 신약 시장의 황금알> 편을 참고하기 바란다. GLP-1 작용제가 당뇨치료제로 고성장 시기인 2010년대에 한미약품의 반감기 증가 기술인 랩스커버리 플랫폼 기반의 신약 3종(퀀텀 프로젝트)이 사노피에 계약금 4억 유로(당시 약 5,000억 원) 단계별 마일스톤 35억 유로(약 4.4조 원)으로 최대 5조 원에 달하는 규모로 기술 수출되었다. 랩스커버리 기반의 퀀텀프로젝트는 에페글레나타이드·지속형인슐린·에페글레나타이드+지속형인슐린)으로 주 1회, 월 2회, 월 1회까지 투여 가능하여 환자 순응도 장점이 있다. 랩스커버리는 항체의 Fc 절편을 별도로 만들어 화학적 방법으로 연결시키는 원리로 반감기를 늘리는 기술이다. 고분자물질에 링커를 연결해 약물의 크기가 커져 신장에서 걸러지지 않아 반감기가 증가하게 된다. 랩스커버리 기반의 글로벌 상용화된 제품 1개, 임상 중인 제품은 5개로 한미약품이 국내에서 지속형 파이프라인 보유가 가장 많은 업체이다. ‘24년에는 비만을 타겟하는 삼중작용제(GLP/GIP/GCG)가 1상에 진입할 것으로 보인다. 비록 사노피와 얀센으로부터 랩스커버리 기술 기반의 파이프라인 반환되었으나, ’20.8월 머크에 GLP/GCG 이중 작용제를 NASH 치료제 기전으로 다시 기술 이전을 성사시킨 바 있다. 또한, 호중구 감소증 치료제 롤론티스가 미국 FDA 승인 받고 판매 중으로 고유 반감기 증가 플랫폼 기술의 안전성과 효능이 입증되었다.  한미약품 외에 지속형제제 주요 개발사로는 펩트론이 있다. 펩트론은 약효지속성 제조 및 설계에 대한 스마트데포 기술을 구축하였다. 스마트데포 기술은 약물이 체내에서 서서히 방출되게 하여 약물의 혈중 농도를 높게 유지하고 지속적으로 유지하게 하는 기술이다. 초음파 분무건조를 이용하여 약물을 저장하고 서서히 방출할 수 있는 작은 구슬방울로 대량생산이 가능하다는 장점이 있다. 약물이 들어있는 생 분해성 구슬방울이 혈액에서 서서히 방출되는 것으로 체내 일정한 약물농도를 유지하여 약효가 지속된다. 미립구 기반 서방형 주사제의 어려움은 균일한 품질로 대량생산하는 것인데, 동사는 오송에 ’18.12월 약 200억원을 투자하여 오송에 100만 바이알 규모의 1공장 완공하였고, EU GMP 인증을 획득한 바 있다. 비만 치료제와 같은 만성질환 치료제에 대한 높은 수요와 기술의 발전으로 인한 신약 출시, 코로나 이후 변화된 환경 등으로 다국적제약사의 지속형 제제에 대한 관심이 재차 증가할 것으로 전망된다. 특히, 기술 제휴를 원하는 다국적사는 이미 생산 할 수 있는 공장을 보유한 바이오텍을 선호하는데 한미약품과 펩트론이 자체 공장을 보유하고 있다. 한미약품을 사노피와 당뇨병치료제 등 협업 당시 약 1,730억 원을 투자해 상업화 성공시 대량생산을 위한 바이오 2공장을 건설한 바 있다.  경구 투여는 쉽게 사용할 수 있으나, 체내 흡수율이 떨어지면서 효과가 적게 나타나거나 이를 높이기 위한 고용량을 사용하게 되면서 체내 다양한 생리학적 과정을 거치며 부작용이 나타날 수 있다. 약물 흡수에 영향을 미치는 요인 중 하나로 위장액의 pH가 있으며, 당뇨/비만 치료제 GLP-1의 경구 제제인 리벨서스가 공복에 복용하며 약간의 물과 함께 정제를 쪼개거나 부수거나 씹어서는 안되고 완전히 삼켜야 하는 것도 약물의 흡수율과 관련이 있기 때문이다. GLP-1 유사체의 경구제 개발을 오랜 기간 시도하였으나, 약물의 흡수(생체이용률)가 낮다는 한계점이 있었다. 리벨서스는 최초의 경구용 GLP-1 유사체로 흡수 증진 물질인 SNAC(Sodium N-(8-(2-hydroxybenzoyl) Amino) Caprylate)을 결합해 경구 복용이 가능하다. 다만, 리벨서스 또한 생체이용율이 1% 정도로 흡수율이 주사제 89%에 비해 매우 낮고 구토, 메스꺼움, 설사 등 부작용이 있다. 노보 노디스크는 Emisphere Technologies와 2007년 파트너십을 통해 확보한 경구 투여 기술로 첫 경구 약물 리벨서스가 미국 FDA로부터 상용화 되었으며, 노보는 ‘20년 Emisphere를 18억 달러에 인수하였다. 시판에 성공하게 되면 러닝 로열티를 지속 지급하는 것보다는 풍부한 현금을 보유하고 있기 때문에 인수의 방법을 택한 것으로 보인다. 릴리 또한 경구용 GLP-1 수용체 작용제를 개발하는 일본의 중외제약(Chugai Pharmaceutical)과 ‘18년 계약금 $50mn에 1상 준비 단계의 OWL833에 대한 기술 계약을 맺고, 최근 2상을 성공하고 3상에 진입한 바 있다.  |
* [블로그] 펩트론 : PT105 계약 체결과 바이오 섹터에서 시의성이 갖는 의미 (2023.11.12)
https://m.blog.naver.com/vlvk1703/223262853280
* "다이어트약 위고비, 사망위험 18% 낮춰" 노보노르디스크 (2023.11.12)
https://n.news.naver.com/article/014/0005099298?sid=101
| 덴마크 제약사 노보노르디스크의 다이어트약 위고비(Wegovy)가 사망위험을 18% 낮춰주는 것으로 나타났다. 각국 보건당국과 의료보험사들이 위고비 사용을 확대하는 계기로 작용할 수 있기를 노보노르디스크는 희망하고 있다. 파이낸셜타임스(FT)는 11일(이하 현지시간) 노보노르디스크의 새 임상시험에서 위고비가 심장질환 위험을 억제하는데 '놀라울 정도로 강력한' 것으로 확인됐다고 보도했다. 심장마비 위험 28% 낮춰 노보노르디스크 개발담당 부사장 마르틴 홀스트 랑은 심장질환 사망률과 막대한 치료비 부담을 감안할 때 보건당국과 의료보험사들이 이를 사전에 완화할 수 있는 위고비 사용 확대를 추진할 수 있을 것으로 기대했다. 랑 부사장은 위고비를 복용하면 심장마비 위험을 28% 줄이는 것으로 나타났다면서 상당한 효과가 있다고 강조했다. 노보노르디스크는 이날 미국 심장학회(AHA) 총회와 이날 발간된 뉴잉글랜드저널오브메디신(NEJM)에 임상시험 전체 데이터를 공개했다. 노보노르디스크의 이번 임상시험은 심장질환은 있지만 당뇨병 병력은 없는 45세 이상 성인 1만7600여명을 대상으로 이뤄졌다. 임상시험 기간 458명은 위약(플라세보)을, 375명은 위고비를 투약했다. 이 시험에서 위고비를 투약한 경우 사망 위험이 18% 감소하는 것으로 확인됐다. 통계학적으로 유의미한 수준은 아니었으나 특히 심장혈관 문제에 따른 사망 위험은 15% 줄어든 것으로 나타났다. 앞서 예비 임상시험에서는 위고비를 투약한 환자들이 위약을 투약한 이들에 비해 심장마비 등과 같은 심장혈관 문제로 고통받을 확률이 20% 줄어든 것으로 나타난 바 있다. 신장질환에도 효과 랑 부사장은 이번 임상시험에서는 아울러 위고비가 신장질환과 같은 다른 질병에도 영향을 주는 것으로 확인됐다고 밝혔다. 위고비와 같은 성분을 사용하는 노보노르디스크의 당뇨병치료제 오젬픽의 효과를 모니터링 하는 임상시험 결과로 확인됐다. 랑에 따르면 당시 임상시험에서는 오젬픽이 심장질환에도 효과가 있는 것으로 나타났다. 10월 임상시험 결과는 앞으로 수개월 안에 발표될 예정이다. 노보노르디스크의 임상시험 결과는 8일 미국 제약메이저 일라이릴리의 다이어트약 젭바운드(Zepbound)가 식품의약국(FDA)으로부터 비만치료제 승인을 받은 지 이틀 만에 나왔다. 릴리 역시 노보노르디스크처럼 당뇨병치료제 몬자로(Mounjaro)와 같은 성분의 젭바운드를 비만치료제로 만들었다. 노보노르디스크의 위고비는 릴리의 젭바운드보다 조금 더 비싸다. 위고비는 한 달치가 1300달러(약 171만원)로 릴리가 책정한 젭바운드 한 달치 가격 1060달러(약 139만원)보다 고가다. 젭바운드는 올해 안에 출시될 전망이다. 비만치료제, 제약계 차세대 먹을거리 코로나19 백신 업체인 영국 아스트라제네카도 다이어트약 시장에 뛰어들었다. 아스트라제네카는 중국 바이오텍 업체 에코진(Eccogene)과 협력해 다이어트약을 개발 중이다. 제약사들의 차세대 먹을거리로 비만치료제가 급부상하고 있다. 제약사들은 한 편으로는 암 백신 개발에 몰두하면서 다른 한편으로는 비만치료제 개발에 열을 올리고 있다. 릴리는 다이어트약 돌풍에 힘입어 올해 시가총액 기준 미 최대 제약업체로 등극했다. 또 노보노르디스크는 위고비를 발판 삼아 프랑스 명품재벌 모에헤네시루이뷔통(LVMH)을 제치고 시총 기준 유럽 1위 상장사가 됐다. |
* 위고비 AHA학회 SELECT Study 결과 발표 – by 리아멍거 (2023.11.12)
  AHA학회에서 비만환자를 대상으로 진행 된 SELECT Study과 발표되었습니다. SELECT 연구는 41개국 804개 센터에서 CVD가 있는 45세 이상의 총 17,604명 평균 BMI가 33.3의 환자로 진행되었습니다. 이미 90.1% 환자가 고지혈증치료제, 86.2%의 항혈소판제, 70.2%의 베타 차단제, 45.0%의 ACE 억제제, 29.5%의 ARB를 복용한 환자들을 대상으로 진행 되었고 추가적으로 세마글루타이드 치료시 MACE의 효과를 비교했습니다. 그 결과 1차종료점(Primary endpoint) MACE 20% (CV 사망률은 15% 감소, MI은 28%로 감소, Stroke은 7%)로 감소시켰고, NNT=67로 매우 좋은 데이터 결과값이 발표 되었네요. 재미있는 부분은 체중감소가 발생하기 전부터 플라시보 군과 간격이 벌어지기 시작하네요. 단순히 살만 빠져서 나온 효과가 아니라는 것을 반증하기도 하네요. 심부전 발생, 모든 사망 원인은 각각 18%,19% 감소하였으나 통계학적으로 유의성은 보이지 못하였고, 방향성만 확인 되었습니다. 부작용에서도 의미있는 결과가 발표되었습니다. 위장관 장애 발생에서 더 높은 부작용이 세마글루타이드 군에서 발생하였고, 담낭 관련 질환은 세마글루타이드가 약간 더 빈번(2.8% 대 2.3%; P=0.04)했지만, 암, 급성 신부전, 급성 췌장염 등 다른 특이적 부작용은 두 그룹에서 비슷한 비율로 발생했습니다. 주목할 만한 점은 GLP-1 수용체 작용제와 관련된 자살 충동에 대한 보고가 규제 당국에 의해 추적되고 있는 가운데, 세마글루타이드 그룹에서 정신 질환이 더 높지 않았습니다.(0.7% 대 0.6%) 이제 비만도 치료제가 생겼으니 질병으로 분류하고 보험 적용을 진행 할 수 있는 근거가 생겼다고 판단됩니다. 비만치료제는 다시 한번 날개를 달았네요. 조기주식회 텔레그램(t.me/EarlyStock1) |
* 펩트론 회사 공지 (2023.11.10)
http://www.peptron.co.kr/ds4_1_1.html?db=newsp&no=82&c=view&page=1&SK=&SN=&kind3=&idx=

* 펩트론 PT-105 LG 화학 계약 공시 – by 리아멍거 (2023.11.10)
| 펩트론이 LG화학과 PT-105 계약을 체결했습니다. PT-105의 적응증은 자궁내막증, 자궁근종, 전립선암, 폐경전 유방암, 성조숙증 등이 있습니다. 국내 성조숙증 치료제 시장 규모는 연 1,800억 수준입니다. 전립선 치료제는 오리지널은 다케다의 루프린이며 글로벌 매출 2조 6천억 판매를 보이고 있습니다. 국내는 800억 시장, 중국 7천억, 유럽은 5,600억, 미국 1.2조 원, 일본 4천억의 시장을 가지고 있고, 오늘 공시는 국내 판매 계약에 대한 내용입니다. 오리지널 루프린 대비 장점은 주사 두께가 작어 통증감소가 되는 장점을 가지고 있습니다. 과거 대웅제약 계약과 다르게 이번 LG화학 계약은 단순히 매출 로열티만 받고 원료공급을 진행한 것이 아니라 생산 및 납품을 가능하기에 매출과 마진율이 크게 개선될 것으로 보입니다. 이번 공시로 계약금도 들어오고 내년부터 현금 창출 능력도 좋아지며 PT-403,404에 대한 계약 시 업프론트도 들어오기에 시장에서 걱정한 자금조달 risk는 없어 질 거 같네요. 이번 LG화학이라는 대기업과 생산능력까지 인정받은 계약을 진행했기 때문에 글로벌 빅파마들과의 협상에서도 이런 부분도 크게 작용 할 것으로 보입니다. 루프린의 생물학적 동등성을 재현한 제네릭은 국내에 없으며, 미국과 유럽등에도 찾아보기 어렵습니다. 이번 계약으로 펩트론은 1달 제형에 대한 신뢰도가 높아졌다고 말씀드리고 싶습니다. 조기주식회 텔레그램(t.me/EarlyStock1) |
* 공시 - 전립선암 및 성조숙증 치료제 '루프원'국내 판권 계약 체결 (2023.11.10)
https://dart.fss.or.kr/dsaf001/main.do?rcpNo=20231110900138
* 펩트론 회사 공지 (2023.11.06)
http://www.peptron.co.kr/ds4_1_1.html?db=newsp&no=81&c=view&page=1&SK=&SN=&kind3=&idx=

* 펩트론 : 노보 노디스크와 일라이 릴리 사이, 다가오는 결정의 시간 (2023.11.03)
https://blog.naver.com/vlvk1703/223254184485
* 펩트론 회사 공지 (2023.10.26)
http://www.peptron.co.kr/ds4_1_1.html?db=newsp&no=80&c=view&page=1&SK=&SN=&kind3=&idx=

- 유럽 소재 글로벌 제약사 -> 노보노 디스크
- 미국 소재 글로벌 제약사 -> 일라이 릴리
* 기술은 나이를 되돌린다 - 삼성증권 (2023.10.17)
| 당뇨/비만 치료제 GLP-1 당뇨 환자들에게 처방되는 대표적인 치료제는 GLP-1(Glucagon like peptide) 유사체로 췌장의 베타 세포를 활성화시켜 인슐린을 분비하여 혈당을 조절하며, 뇌의 식욕 중추를 억제하여 식욕을 낮춰 체중 감소에도 효과가 있다. 또한 음식물이 위에서 배출되는 것을 지연시켜 탄수화물 흡수를 느리게 하여 급격한 혈당 상승을 막을 수 있다. 오리지널 GLP-1의 반감기는 약 2분 정도로 매우 짧기 때문에 의약품으로 사용되기 위해서는 반감기를 늘린 변형 GLP-1 개발이 필요하다. 변형된 GLP-1 유사체는 GLP-1 receptor agonist(GLP-1 수용체 길항제)를 줄인 GLP-1 RA라 불린다. GLP-1 RA 개발 초기에는 1일 1회 주사 제형의 Eli Lilly의 exenatide, Novo Nordisk의 liraglutide에서 시작하여 2014년에 Eli Lilly의 1주 1회 주사 제형인 dulaglutide, 2017년에는 Novo Nordisk의 1주 1회 주사 제형인 semaglutide, semaglutide에 Eligen 기술을 적용한 경구용 GLP-1 RA 등이 개발되었다. 최근에는 GLP-1 수용체만을 자극하는 단일 기전이 아니라 GLP-1 수용체와 함께 인크레틴 호르몬인 GIP 수용체를 동시에 자극하는 이중 기전의 GLP/GIP RA 개발도 이루어졌다. 대표적인 제품은 Eli Lilly의 tirzepatide로 GLP-1 단일 작용제보다 혈당 조절 및 체중 감소 효과가 뛰어난 것으로 밝혀졌다. Novo Nordisk의 semaglutide: Semaglutide는 Novo Nordisk의 1주 제형 GLP-1 RA로 SUSTAIN 연구를 통해 혈당 강하 효과 및 STEP 연구를 통해 체중 감소 효과를 입증했다. 지난 2분기 실적에서 당뇨 치료제 Ozempic(성분명 semaglutide) 59% y-y, Rybelsus(경구, 성분명 semaglutide) 90%, 비만 치료제 Wegovy(성분명 semaglutide) 543%의 성장을 보여줬다. Wegovy는 인플루언서를 중심으로 비급여 처방이 확대되고 있다. 미국에서는 비급여 처방시 월 1,350달러로 소득 수준이 높은 환자들이 처방을 선호하고 있다. Wegovy 보험 급여는 BMI 지수 30 이상인 고도 비만 환자에게 적용이 가능하기 때문에 Wegovy 처방을 받기 어려우나, 제2형 당뇨를 가진 환자의 경우 Wegovy 대신 Ozempic 처방을 선호하여 Wegovy와 함께 Ozempic 처방도 확대되고 있다. Rybelsus는 지난 1월 FDA로부터 제2형 당뇨 환자 대상 1차 치료제 승인 이후 의사들의 적극적인 처방 확대로 1분기에 이어 2분기에도 가파른 성장이 지속되고 있다. Eli Lilly의 tirzepatide: Eli Lilly의 tirzepatide는 SURPASS 연구를 통해 혈당 강하 효과를 입증했다. SURPASS-2 임상 3상에서 경쟁약물인 Novo Nordisk의 semaglutide와 비교 임상을 했는데, semaglutide 대비 우수한 혈당 강하 효과를 입증했다. 2022년 2분기 FDA로부터 제2형 당뇨 치료제로 품목 허가 승인을 받았으며, 2Q23 당뇨 치료제 Mounjaro(성분명 tirzepatide)는 매출액 9.8억 달러(2Q22 1,600만 달러)를 기록하며, 가파른 성장세를 확인할 수 있다. Eli Lilly는 tirzepatide의 체중 감소 효과를 확인하기 위해 SURMOUNT 연구를 진행했다. 당뇨없는 비만 환자 대상 SURMOUNT-1, 당뇨 있는 비만환자 대상 SURMOUNT-2 임상 3상에서 15% 이상의 체중 감소 효과를 확인했다. 지난 6월 FDA에 비만 치료제로 허가 신청을 했으며, 연내 SURMOUNT-1, 2 결과 기반으로 FDA로부터 비만 치료제로 허가가 예상(Fast Track 지정)된다. 지난 2분기에는 체중 관리 목적의 SURMOUNT-3, 체중 유지 목적의 SURMOUNT-4 임상 3상 결과를 발표했으며, 각각 84주 26.6%, 88주 26%의 체중 감소 효과를 확인했다. Amgen의 AMG133: Amgen의 AMG133은 한 달에 1회 투약하는 제형으로 GIP 항체에 GLP-1 펩타이드를 붙인 형태로 GIP 발현을 낮춰 BMI를 낮추는 기전이다. 2022년 12월 WCIRDC(세계 인슐린 저항성, 당뇨 및 심혈관 질환 컨퍼런스)에서 AMG133의 임상 1상 결과를 발표했다. 임상 1상에서 BMI 30-40 비만 환자 대상으로 AMG133을 투약한 결과 MAD(다중용량상승시험) 시험군에서 420mg 투약한 환자의 체중이 14.5% 감소했다. 직접 비교 임상은 아니지만 tirzepatide가 12주 8% 체중 감소인 것을 감안하면 AMG133은 체중 감소 효과에서 우위에 있다. 현재 임상 2상 중이며, 시장 발매까지 다소 시간이 걸릴 것이다. 또한 항체 기반으로 제작되었기에 의약품 가격도 기존 펩타이드 기반 치료제 대비 비쌀 것으로 예상된다. 그럼에도 한 달 1회 투약 제형, 우수한 체중 효과를 감안하면 시장 파급력은 클 것이다. 후속 비만/당뇨 파이프라인의 개발 1) 플랫폼 다변화: 기존 펩타이드 제형에서 항체 기반 또는 합성의약품 기반으로 개발이 확대되고 있다. GLP-1 펩타이드 제형의 대표 제품인 Rybelsus는 semaglutide 용량 25, 50mg으로 기존 주사제형 대비 최소 10배 이상의 용량을 필요로 한다. 효율적인 생산을 위해 펩타이드 합성이 아닌 저비용으로 대량 생산이 가능한 합성의약품으로 대체하기 위한 시도가 이루어지고 있다. Pfizer는 경구용 1일 1 투약 가능한 non-peptide GLP-1 RA lotiglipron(임상 1/2상)에 대해 최근 안전성 문제로 임상을 중단했으나, 1일 2회 복용이 필요한 non-peptide GLP-1 RA danuglipron(임상 2상)을 개발 중에 있다. Eli Lilly도 nonpeptide GLP-1 경구 치료제인 LY3502970에 대해 임상 3상을 진행하고 있으며, 2025년 두 건의 임상 3상 결과가 발표될 예정이다. 2) 반감기 개선: 주 1회 제형을 넘어서 월 1회 제형 개발도 이루어지고 있다. Amgen의 AMG-133은 항체 기반으로 월 1회 주사 제형으로 임상 2상을 진행하고 있다. GIP의 수용체를 타깃으로 하는 항체에 GLP-1 RA 펩타이드 두 가닥을 연결하여 GLP/GIP 이중 작용의 효과를 기대하고 있다. 3) 안전성 이슈: 지난 7월 아이슬란드에서 Saxenda, Wegovy 등 비만 치료제 처방 환자들 중에서 자살 충동과 자해 사례가 발생했다. 유럽 당국은 약물에 대한 조사를 시작했다. 반면 FDA에서는 약물과의 인과 관계를 확립하기에는 정보가 불충분하다는 입장을 제시했다.   GLP의 또다른 잠재력 Eli Lilly, Novo Nordisk의 장기지속형 GLP-1 치료제가 비만/당뇨 분야에서 처방이 가파르게 늘어나면서 주목을 받았다. GLP-1에 대한 연구는 비만, 당뇨에 그치는 것이 아니라, 심혈관, 심근염, 말초혈액질환 외에 NASH, 알츠하이머 등 혈관질환 및 염증 질환 분야에서도 GLP-1의 효능을 확인하기 위한 임상이 진행되고 있다. 노화의 주요 원인은 염증?: 노화의 주요 원인으로 몸속에 생기는 염증이 제기되어 왔다. 나이가 들면서 노화 세포라 불리는 분열이 멈춘 세포가 몸 안에 축적된다. 축적된 노화세포는 다양한 염증 물질을 분비하여 질병을 유발할 수 있다. 세포에 축적되는 염증 반응을 줄여줄 수 있다면 노화와 관련된 질병(알츠하이머, 심혈관, 암 등)의 증상을 완화할 수 있다는 가설이 세워진다. 메트포르민의 또다른 효과: 60년 이상 당뇨 치료제로 사용되어 온 메트포르민은 정확한 분자 기전은 밝혀져 있지 않으나, 효능 측면에서는 간에서 포도당 생산을 줄이고, 인슐린 민감도를 높여 혈당 조절을 한다. 메트포르민은 특허가 이미 오래전에 만료되어 시중에 유통되는 약은 제네릭으로 한 달 투약 가격은 2만 5천원 정도로 저렴하다. 또한 60년 동안 처방되어온 치료제로 위장 관련 일부 부작용이 보고된 것 외에는 안전한 약물이다. 최근에는 메트포르민의 항노화 효과에 주목하고 있다. 항노화에 대한 정확한 정의는 노화 관련 질환의 예방 및 치료를 의미한다. 메트포르민은 1998년 보고된 연구에 따르면 심혈관 관련 이점이 보고되면서, 메트포르민은 심혈관으로 인한 사망률과 질병에 의한 노화를 감소시킬 수 있다는 점을 제시했다. 다수의 연구에서 메트포르민을 처방받은 제2형 당뇨 환자는 메트포르민을 처방받지 않은 환자 대비 생존율이 향상되었다. 메트포르민은 후행적 분석을 통해 암 발생 위협을 낮추고, 인지 저하와 알츠하이머를 지연시킨다는 연구도 발표되었다. 이와 같은 연구를 근거로 2015년 FDA는 미국 아인슈타인 연구소의 당뇨 치료제의 메트포르민에 대한 노화 지연 목적 임상 개시를 허가했으며, 이는 노화를 질병으로 인정하는 첫 임상이 되었다. 해외에서는 2018년 노화 자체에 질병 코드가 부여되면서 노화는 직접적인 예방과 치료가 가능한 질병으로 분류되었으며, 노화를 조절할 수 있는 의약품 개발을 적극적으로 하고 있다. GLP-1의 새로운 잠재력: GLP-1의 항염증 효과가 메트포르민을 넘어설 수 있을지에 대한 확인이 필요하다. GLP-1을 통한 신호 전달 활성화는 염증 반응을 감소시키는 것으로 밝혀졌다. GLP-1 RA의 초기 제제인 liraglutide는 산화 스트레스와 염증을 감소시켜 패혈증에서의 혈관 기능을 향상시켰으며, Nf-κB의 활 성화 감소, TNF-α 억제, 산화질소 생성 증가 등으로 내피세포에서의 항염증 효과를 확인했다. Exenatide는 조절 T세포를 활성화시켜 염증 반응을 줄였다. GLP-1은 간, 심장 등 여러 조직에서 염증 반응을 낮추는 효과가 입증됐다. 1) 심장: 만성 심부전증 환자 및 심근병증 환자에서 GLP-1 투약은 심장 기능을 향상시켰으며, 심근 경색 후 생존율도 개선시켰다. 지난 8월 Novo Nordisk는 17,000명 당뇨가 없는 비만 및 심혈관 환자 대상 SELECT 임상 3상에서 semaglutide 투약시 심혈관계 위험도(MACE)를 20% 이상 낮췄다는 결과를 발표했다. 미국 공보험인 Medicare 및 사보험에서 Wegovy의 처방을 제한하고 있는만큼 이번 임상 결과로 보험 적용 확대가 기대된다. 연이어 박출률 보존형 비만 관련 심부전 환자 대상 STEPHFpEF 임상 3상에서 semaglutide는 심근병증 증상을 낮추는 것으로 확인되었다. 2) 장질환: 최근 여러 연구에서는 GLP-1은 상피 세포의 재생, T세포의 성장 및 기능 조절, 선척 면역세포의 조절을 통해 염증성 장질환, 단장 증후군 등 광범위한 장질환 치료제로 효과가 확인되었다. 3) 간담도: GLP-1 치료는 비알콜성 지방간 질환과 비알콜성 지방간염과 같은 간 질환에서의 개선 가능성도 보였다. 비알콜성 지방간염은 지방이 축적되어 발생하는 간염증과 관련이 있다. GLP-1 치료는 간세포의 괴사와 세포 사멸을 줄여 염증 반응을 낮출 수 있다. 또한 지방을 감소시켜 염증의 원인이 되는 지방간 수치도 낮출 수 있다. 2021년 11월 발표된 76명의 NAFLD 환자 대상으로 간섬유화 및 지방간 감소에 대한 semaglutide 효과를 확인해보자. 48주 뒤 MRE(Magnetic resonance elastography)로 측정한 간 경직도(Liver stiffness), MRI-PDFF(MRI proton density fat fraction)로 측정한 간 지방증(Liver steatosis)의 변화를 확인했다. Semaglutide 0.4mg를 매일 투약했을 때 간 경직도는 24주나, 48주, 72주에서 placebo 대비 변화가 없었으나, 간 지방증은 placebo 대비 크게 감소했으며, 대부분의 환자들이 30% 이상 지방간이 감소된 것을 확인했다. 2021년 3월 NEJM에 NASH 섬유화 단계 F1-3 환자 320명 대상 semaglutide 0.1, 0.2, 0.4mg 매일 투약후 72주간 관찰한 임상 2상 결과를 발표했다. 1차 지표로 섬유화 악화 없이 NASH 개선된 환자비율은 semaglutide 0.4mg에서 59%, placebo는 17%(p<0.001)를 기록했다. 반면 2차 지표인 NASH 악화 없이 섬유화 개선은 semaglutide 0.4mg에서 43%, placebo는 33%(p=0.48)로 통계적 유의성을 입증하지 못했다. FDA 가이드라인에 따라 2개의 지표 중 하나만 충족하더라도 품목 허가 승인이 가능하여 semaglutide는 현재 임상 3상을 진행하고 있으며 2028년 임상 종료 예정이나, 중간 결과는 2025년에 발표 예정이다. 2023년 3월 The Lancet에 발간된 semaglutide의 NASH 간경화를 동반한 섬유화 단계 F4 환자 71명 대상 임상 결과를 살펴보자. 생검으로 NASH 관련 간경화(cirrhosis)가 확인된 환자 대상으로 semaglutide를 2.4mg(주 1회 투약으로 매일 0.4mg 투약과 동일)과 placebo의 효과를 비교했다. 1차 지표는 투약 48주 후 NASH 악화 없이 1단계 이상의 간 섬유화증에 대한 개선 비율로 semaglutide 투약군과 Placebo 사이에서의 통계적 유의성이 없었다(11% vs 29% p=0.087). NASH가 개선된 환자들 비율에서도 통계적 유의성이 없었다(p=0.29). Semaglutide 투약은 체중 감소 효과와 혈당 감소 효과가 명확히 유지된 것을 확인할 수 있었다. 4) 중추신경계: GLP-1 RA는 혈액-뇌 장벽 투과성이 좋아 뇌에서 식욕을 조절하는 호르몬을 조절하기 때문에 뇌 질환 치료제로 직접적으로 사용될 수 있다. 치매는 뇌에 염증이 생겨 문제가 발생하는데, GLP-1이 치매 위험을 낮춘다는 결과가 있다. GLP-1 RA인 liraglutide 관련 LEADER, semaglutide의 SUSTAIN-6, PIONEER-6 연구 결과에서 3년 추적 관찰 후에 치매 발생 정도를 확인했다. 치매 관련 위험비는 GLP-1 RA군에서 53% 낮은 것을 발견했다. 다른 연구에서도 GLP-1 RA는 혈관과 뇌 염증에 효과가 있다는 결과가 쌓이고 있다. Novo Nordisk는 semaglutide 14mg에 대해 알츠하이머 초기 환자 대상 임상 3상을 진행하고 있으며, 2025년에 1차 결과가 발표될 예정이다(EVOKE 연구). 5) 중독: 최근 semaglutide에 대해 의사와 환자들의 알코올 및 흡연 중독 치료 효과 사례가 보고되고 있다. 오클라호마주립대 연구소에서는 Novo Nordisk의 지원을 받아 semaglutide 실사용 데이터를 기반으로 알코올 중독 치료 임상 2상(STAR-T)을 진행하고 있다  GLP-1이 산업에 미치는 파급력 GLP-1 약물의 파급 효과는 산업 전반에서 광범위하게 나타날 수 있다. 하지만 GLP-1 약물의 가격, 제한된 공급, 보험 급여 여부 등을 고려하면 단기간에 타 산업에 영향을 미치기는 어렵다. 그럼에도 불구하고 미국 내에서 7% 이상의 사람들이 비만/당뇨 치료제를 처방받으면서 실제 음식 소비에서의 변화가 나타나기 시작했다. 미국 내에서의 GLP-1이 산업에 미치는 영향을 살펴볼 필요가 있다. 1) 의료기기: 지난 10월 초 노보 노디스크의 semaglutide에 대해 만성신장질환 임상 3상 FLOW 연구에 대한 긍정적 결과를 발표하면서 DaVita, Baxter, Fresenius 등 투석 서비스 및 장비 제공 업체들의 주가가 하락했다. 지난 8월에는 semaglutide에 대해 심장질환 임상 3상에서 심혈관 위험도를 낮춘다는 보고로 혈당측정기기의 사용이 줄어들 것이라는 우려로 Dexcom, Medtronic 기업의 주가가 빠졌으나, 실제로는 비만 치료제 복용 이후 오히려 연속혈당측정기의 사용이 증가한 것으로 밝혀지면서 주가는 회복세에 있다. 2024년에는 일라이 릴리의 tirzepatide에 대해 폐쇄성 수면무호흡증 임상 3상 결과가 발표 예정이다. GLP-1 약물을 복용하는 사람들은 체중 감소 효과 덕분에 수면 무호흡증 관련 문제를 덜 겪는다는 보고가 되어 있다. GLP-1 투약 증가로 수면무호흡증 CPAP(양압기) 기계 수요 감소가 예상되면서 양압기 판매 업체 Inspire Medical, Resmed 주가도 급락했다. 2) 음식: 살찌는 음식과 관련된 기업들(Coca cola, pepsi)의 주가가 연일 하락세에 있다. 2023년 비만치료제 Wegovy, 당뇨 치료제 Ozempic 및 Mounjaro 등의 off-label 처방 확대로 비만에 타격을 주는 음식 소비가 줄어들 것으로 보고 있다. 월마트 미국 부문 최고 경영자 John Furner는 비만 치료제로 인해 장바구니 수요가 약간 감소했다고 코멘트를 했다. 실제 경기침체로 인한 수요 위축인지, 비만 치료제로 인한 영향인지에 대한 구분은 명확하지는 않지만 8월 전문가의 분석에 따르면 미국 비만 치료제의 처방은 전체 인구의 7%를 차지할 것으로 예상됨에 따라 음식 소비 변화(포장 식품, 음료, 레스토랑, 체중 감량 프로그램 등)에 광범위한 영향을 미칠 것은 명확하다. 3) 담배/술/도박: GLP-1 투약 환자들은 알코올, 니코틴, 오피오이드에 대한 갈망과 온라인 쇼핑 및 도박과 같은 일부 강박 행동에도 변화가 생겼다. 중독과 관련된 질환에 대해 GLP-1 치료제가 효과가 있다면 담배, 술, 도박 수요 역시 줄어들 수 있다. Morgan Stanley 설문조사에 따르면 GLP-1을 투약 받는 동안 62%의 참여자는 술을 덜 마셨다고 답했으며, 25%는 술을 완전히 끊었다고 응했다. 도박과 술은 파레토의 법칙처럼 소수의 이용자가 다수의 매상을 올리는 경향이 있기 때문에 GLP-1의 파급력은 클 것으로 예상된다. Anheuser-Busch, Molson Coors, Altria를 포함한 맥주 제조업체와 담배업체와 더불어 Boyd Gaming, Churchill Downs 등 카지노 업체에도 부정적일 것이다.  |
* 신약 시장의 황금알 : 바야흐로 GLP-1 시대 - 키움증권 (2023.08.23)
| 바야흐로 GLP-1 시대 GLP-1 진격의 비만 확장 GLP-1이란? GLP-1 RA(Glucagon-like peptide-1)이란 글루카곤 유사 펩타이드로 영양소 섭취 후 장의 L-세포에서 생성되는 장관내 영양분 또는 혈당 농도에 자극을 받아 분비되는 호르몬이다. 췌장, 위장관, 뇌, 심장 및 신장을 포함한 다양한 기관에 분포하는 GLP-1 수용체를 활성화하여 다양한 생리적 효과를 발휘한다. 포도당 수치가 올라가면 췌장에서 GLP-1이 인슐린 분비를 촉진하고, 글루카곤 분비를 감소시켜 포도당 수치를 감소시키는데 기여한다. 포도당 수치가 정상일 때는 거의 영향을 미치지 않기 때문에 항당뇨병 약물의 일반적인 부작용인 저혈당 부작용 위험이 적어 당뇨병 치료에 주로 활용되고 있다. 또한, 다른 조직과 기관에도 긍정적 영향을 미치는데, 위장관에서 GLP-1은 위 배출을 지연시키고, 식후 포도당 수치를 낮춰주며 신경계에서 GLP-1 수용체를 활성화하여 포만감을 높이고 에너지 섭취를 억제하여 체중을 줄이는데 도움을 준다.    당뇨에서 비만으로 확장ing 주로 당뇨 치료제로 잘 알려진 GLP-1(글루카곤 유사 펩타이드) 수용체 작용제의 시장규모는 ‘22년 $23.4bn(약 30조원, YoY +32%)로 ‘16~’22년 6년 동안 연평균 +29%씩 성장하였다. GLP-1 시장은 ‘28년 $72.9bn(약 97조원)에 이를 것으로 전망되고 있으며, 최근 노보노디스크의 심혈관 질환 예방에 대한 긍정적데이터가 발표되며 전망치가 지속 상향되고 있다. 특히, 최근 비만치료제로 노보노디스크의 위고비가 수요 대비 공급 부족 이슈가 불거졌고, 릴리의 마운자로와 레타트루타이드의 비만 치료제 데이터가 미국 당뇨병학회(ADA)에서 화두가 되면서 비만 치료제로의 시장 성장이 기대되고 있다. ‘22년 GLP-1 시장에서 2형 당뇨병 치료제가 차지하는 비중은 90%, 비만 치료제는 10%였던 것에 반해, ‘28년에는 당뇨병 61%, 비만 36%로 비만치료제가 차지하는 비중이 증가할 것으로 예측된다. 당뇨병 치료제에서 선두주자로 주도권을 보유한 글로벌 다국적 제약사로는 릴리와 노보노디스크가 있으며, 특히 GLP-1 시장에서 점유율을 양분하고 있다. 노보노디스크가 ‘22년 기준 점유율 49%로 릴리의 34% 보다 앞서지만, 릴리의 마운자로(GIP/GLP-1R A)가 맹추격하고 있고, 후발 제품인 Retatrutide(GCG/GIP/GLP-1RA)에 대한 시장 기대감 또한 높다. 노보와 릴리 외에 다른 다국적 제약사(예, Amgen, Pfizer, BI 등)도 비만 치료제 시장에 뛰어들고 있다. 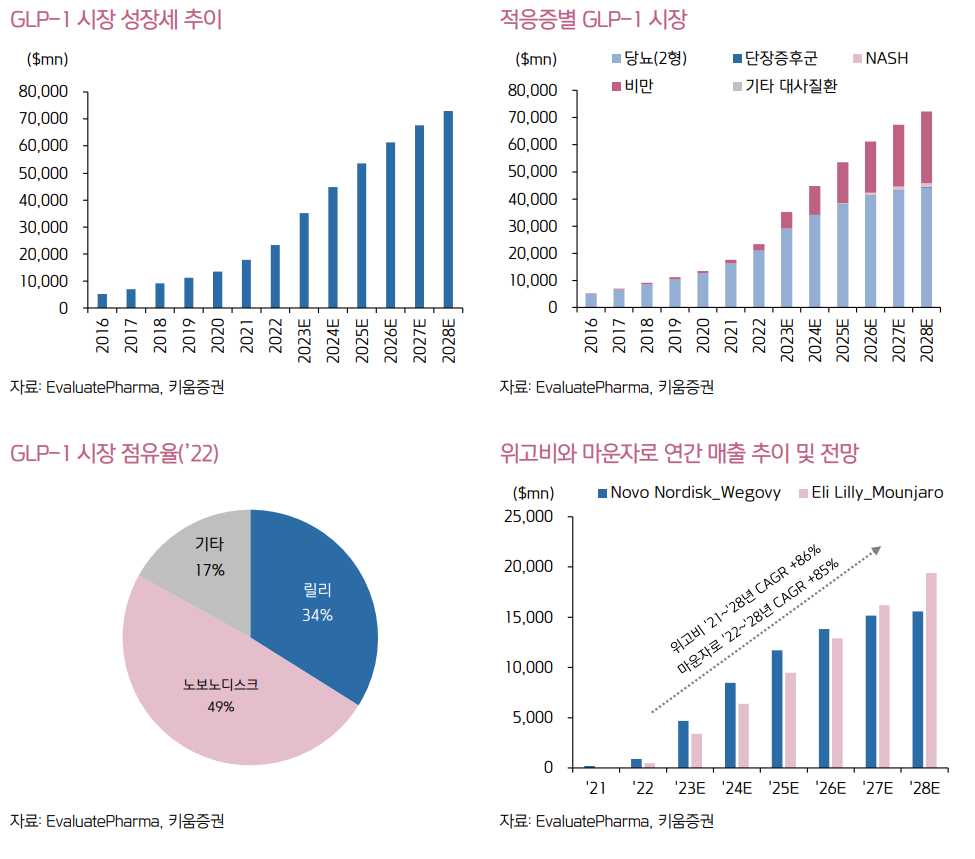    비만에서 심혈관 등 대사질환으로 확대 노보 노디스크는 GLP-1 작용제인 당뇨/비만 치료제 Semaglutide 의 심혈관 질환 3 상(SELECT) 결과를 발표, 심혈관 질환 부작용을 20% 감소시켰다. 당뇨병 이력이 없는 BMI≥27kg/m2 45 세 이상의 성인 17,604 명 참여하였고, 표준 치료 외에도 주요 심혈관 부작용(MACE) 예방하기 위해 세마글루타이드 2.4mg 또는 위약 투여. 체중 감량을 위해 위고비를 치료 받은 사람들이 최대 5 년 동안 위약 대비 MACE 가 통계적으로 유의미하게 20% 감소한 것으로 나타나 주 평가지표 달성하였다. 이는 당뇨병이 없는 사람들의 심혈관 위험 감소를 보여준 첫 데이터로 게임 체인저 데이터로 평가되고 있다. 노보 노디스크는 올해말 세부 데이터를 공개할 예정이며, 적응증 확장을 위한 규제 승인을 모색할 계획이라고 언급하였다. GLP-1 약물이 당뇨, 비만 치료제 뿐만 아니라 심장 질환을 예방하는 치료제로 자리 잡을 가능성이 높아지고 있어, 비만치료제가 단순 미용 목적 이외에도 비만으로 파생되는 많은 질병들에 대한 위험이 줄어 들 수 있다는 점을 시사하였다. 이번 데이터로 인해 GLP-1 비만 치료제에 대해 수요가 더욱 높아질 것으로 전망되며, 현재 위고비 등의 약물 공급이 부족하나, 릴리, 노보 등이 이를 대응하기 위한 생산 시설 확대 중이다. 비만은 제 2 형 당뇨병, 심혈관 질환, 골관절염, 수면 무호흡증 및 NASH 를 비롯한 만성 질환의 주요 원인이며, 미국 의료 비용의 84%가 만성 질환으로 인한 것으로 추정된다. 이번 위고비 연구 결과와 향후 몇 년간 긍정적인 추가 데이터가 발표된다면 심혈관 예방 혜택과 만성 질환의 발생률 감소를 입증하게 되어 보험사는 GLP-1 에 대한 보장 범위를 확대할 것으로 기대된다. 향후 3~5 년간 만성질환으로 확대될 수 있는 데이터 발표가 줄줄이 대기 중이다. 릴리는 2024 년초 마운자로(Tirzepatide)의 NASH 2 상 완료, 마운자로 폐쇄성 수면 무호흡증 3 상 2024 년초 완료, 만성신장 질환이 있는 비만 환자에 대한 마운자로 2 상 2025 년 종료, 심혈관 위험이 증가된 제 2 형 당뇨 비만환자 대상으로 경구용 GLP-1 orforglipron 3 상 2025 년 종료, 심혈관 평가 변수에 중점을 둔 비만 환자 사망률 감소 3 상 2027 년 종료 예정이다. 다중 작용제 시장 확대 촉진 단일에서 이중으로, 이중에서 삼중 시대 개막 단일 어고니스트(Agonist)는 작용제로 세포가 현재 하고 있는 일을 수정하도록 하는 세포 단백질인 수용체(receptor)를 활성화하여 생물학적 반응을 일으키는 화학 물질이다. 길항제(Antagonist)는 작용을 차단하여 다른 물질의 작용이나 효과를 멈추게 하는 반면, 어고니스트는 세포에 결합하여 정상적으로 수용체에 결합하는 물질과 동일한 작용을 일으킨다. 듀얼 어고니스트(Dual Agonist)와 트리플 어고니스트(Triple Agonist)는 이중 또는 삼중의 다중 경로로 동시에 치료하는 데 사용되며 단일 수용체 작용제보다 더 복잡하고 강력한 치료 효과를 나타낼 수 있다. 예를 들면, 당뇨병 치료에서 이중 작용제는 GLP-1과 GIP 수용체를 모두 활성화하여 포도당 조절 및 식욕 조절을 개선할 수 있다. 강력한 효과에도 다중 작용제 개발이 쉽지 않은 주요 요인으로는 다음과 같다. 1) 효과적으로 활성화될 수 있는 표적을 2~3개 찾아내는 것이 쉽지 않고, 그 비율(ratio) 균형을 맞추기 어렵다. 2) 오프 타겟 효과를 최소화하면서 높은 특이성과 친화도로 다중 표적에 결합할 수 있는 분자를 설계하는 것이 어렵다. 3) 설계 한다고 해도 안전하고 효과적인지 확인하기 위해 광범위한 실험 필요하다.  개발이 쉽지 않았던 다중 작용제에서 릴리가 마운자로(GLP-1, GIP)에 이어 레타트루타이드(Triple G, GLP1/GIP/GCG)의 효능이 밝혀지며 연타석 홈런을 날렸다. 이중 작용제(듀얼 어고니스트)로 가장 상용 성공성이 높은 것은 릴리의 주1회 투여 마운자로(GIP, GLP-1RA)이며, ’22.5월 제2형 당뇨병 치료제로 출시하여 ‘22년 $483mn의 매출을 기록하였다. 출시 6년만인 ‘28년에는 예상 매출액 $19bn(약 25조원)이 전망되고 있으며, 현재 비알코올성지방간염(NASH) 3상, 비만 3상, 폐쇄성 수면 무호흡증(OSA) 3상, 만성 심부전(CHF) 3상 중으로 적응증 확장이 기대된다. 위고비가 선두를 달리고 있는 가운데, 최근 릴리의 1주1회 투여 가능한 이중 작용제 마운자로가 3상 최대 용량(15mg)에서 체중 감량 효과 22.5%의 강력한 항비만 효과를 확인하였다. 릴리는 FDA에 비만 치료제로 승인 신청하여 이르면 연내에 정식 허가가 예상된다. 시중에 판매되고 있는 비만치료제 체중 감소율이 통상 5%~17%인 점을 감안하면 최대 22.5%의 체중 감소율을 보인 듀얼 어고니스트 마운자로의 체중 감량 효과가 가장 우수하다. 게다가 이번 미국 당뇨학회(ADA)에서는 릴리가 개발하고 있는 삼중 작용제 레타트루타이드(GIP/GLP1/GCG)의 2상 결과가 공개되었으며, 당뇨병이 없는 과체중/비만 환자의 48주째 12mg군에서 체중이 24%를 기록하였다. 마운자로의 최대 기록 22.5% 보다 더욱 짧은 시간내에 더욱 높은 효과를 나타내어, 체중 감소 최강자로 자기 자신과의 경쟁을 이어가고 있다. 레타트루타이드군의 가장 흔한 이상반응은 위장관계로 대부분 경도~중등도 수준으로 GLP-1 수용체 작용제 또는 마운자로(GIP/GLP-1)에서 보고된 것과 비슷했다. ‘28년까지 비만치료제 시장에서 위고비와 마운자로가 선두를 달릴 것으로 보이며, 삼중 작용제인 레타트루타이드가 ‘26년 출시하게 된다면 마운자로의 바톤을 이어받을 것으로 예상되어 삼중 작용제의 시대를 열 것으로 전망된다.   국내사 대부분 후발 주자. 유한 NASH에서 선두 국내 제약사들도 후발주자이나 다중 작용제를 개발하고 있다. 한미약품은 랩스 커버리 기술 기반의 이중 작용제(GLP/GCG) Efinopegdutide는 MSD에 기술이전되어 NASH 적응증으로 2b상 중이다. 지난 6월 유럽간학회에서 Efinopegdutide의 2a상 구두 발표를 하였다. 145명 대상 매주 1회씩 EFI 10mg 또는 위고비/오젬픽 1mg를 8주간 직접 비교 투약하였으며, 주평가지표는 치료 24주 후 기준선 대비 간지방함량(LFC, Liver Fat Content) 감소로 EFI의 간지방함량 평균값은 72.7% vs 오젬픽 42.3% 대비 더 높았다. 간지방함량(LFC) 5% 미만(정상수준)인 환자 비중도 EFI에서 66.7% vs 오젬픽 17.8%로 단일 작용제인 오젬픽보다 이중작용제인 한미약품의 물질이 더욱 우수했다. 다만, 일반적으로 오젬픽이 2.4mg 투약 되는 데에 반해 이번 임상에서는 1mg로 낮은 용량이 사용되었다는 점에서 효과를 더욱 극대화한 임상 설계로 보인다. 2b상은 300명의 환자를 대상으로 2.4mg가 비교 임상으로 사용될 예정이며, ‘25년 하반기 임상 종료 예정이다. 한미약품은 랩스 커버리 기반으로 1주1회 제형의 삼중 작용제 efocipegtrutide(GLP-1/GIP/Glucagon)를 비알코올성 지방간염(NASH)으로 2b상 개발 중이다. 독립 데이터 모니터링 센터에서 효용성과 안전성에 이슈가 없어 용량군 제외 변경없이 임상 진행 권고를 받아 개발 중이며, 특발성폐섬유증으로 적응증 확대하여 임상을 진행하고 있다. 삼중 작용제는 GLP-1과 GIP를 통해서 체중 감량 및 항염증 효과, 글루카곤을 통해서 에너지 대사량 증대를 통한 체중 감량 및 지질 대사 재프로그래밍(항염, 담즙산 생산 감소, 간 손상 감소 등) 효과를 기대하고 있다. 동아에스티도 이중작용제로 GLP-1 수용체와 글루카곤 수용체에 동시에 작용하는 듀얼 어고니스트 비만 치료제 DA-1726 전임상 중으로 올해 하반기 1상 진입(IND) 준비하고 있다. 비만/NASH 치료제 DA1726(GLP1R, GCGR)의 경우 전임상에서 Semaglutide와 Tirzepatide에 보다 더 많은 음식을 섭취함에도 불구하고 유사한 체중 감소 효과를 확인 한 바 있다. ‘24년 상반기 안전성 연구인 1a상에 착수하여 ‘24년 하반기 데이터 결과를 확인할 예정이라고 뉴로보 CEO인 Joe Hooker는 말했다. GLP-1/GCG 이중 작용제는 최근 경쟁사에서 안전성 이슈가 있었기에 1b상에서 안전성 확인한 후에 기술이전을 추진할 것으로 전망된다. GLP-1R 및 GCGR의 이중 작용제 개발하는 Altimmune의 2상 연구결과 2.4mg 용량에서 투여 24주 후 9.7% 체중 감소하였으나, 고용량 투여 환자의 1/4 이상이 메스꺼움 등의 이상 반응을 보여 치료를 중단한 바 있다. 48주 데이터는 4Q23 탑라인이 공개될 예정이다. 반면, 지난 5월 InnoventBiologics/Lilly의 GLP-1/GCGR 작용제 mazdutide는 중국에서 비만치료제로 2상 연구 중에 부작용으로 인해 중단한 환자 없이 1차 지표를 달성하여 현재 3상 중이다. 유한양행 역시 NASH 적응증으로 이중 작용제 YH25724(GLP-1/FGF21)가 있으며, 베링거인겔하임에 기술이전하여 현재 1상 중이다. GLP-1과 FGF21가 각각 단독으로 NASH 치료제 개발 중으로 특히 FGF21은 최근 아케로와 89Bio가 2상에서 긍정적인 결과를 확인한 바 있어 이중 작용제의 효능이 더욱 기대된다. GLP-1은 주로 NASH 해소에 긍정적인 결과를 보였고, FGF21은 간 섬유화에 효과가 있는 것으로 알려져 있다. GLP-1과 FGF21으로 이중작용제 개발은 동사가 가장 앞서 있다. ClinicalTrials.gov에 따르면 임상은 2025.1월 종료될 예정이다. 대세는 제형 변경 다양한 제형 변경 시도 GLP-1 작용제의 단점으로 꼽히는 것은 위장계열 부작용, 투약 중단 후 요요현상, 근육량 감소, 주사 투여의 불편함이 있다. 릴리의 이중 또는 삼중 작용제의 체중 감소 효과가 20% 이상이며 HbA1c가 -2%p대로 충분한 체중 감량 및 항당뇨효과이기 때문에 효과를 더 높이는 경쟁 보다는 편의성 측면에서 소비자 접근성이 유리한 제형 변경 경쟁으로 이동할 것으로 보인다. 노보 노디스크가 GLP-1 수용체 당뇨병 치료제로 점유율 증가 및 매출 성장에 가장 큰 기여를 한 것은 일1회 제형에서 1주 1회 제형이 출시하면서이다. 노보 노디스크의 GLP-1 작용제 당뇨 사업부를 살펴보면, 일1회 투여하는 빅토자가 ‘09년 출시한 뒤로 ‘18년에 1주1회 투여하는 오젬픽이 등장하면서 시장은 오젬픽으로 재편되었다. 빅토자의 미국 특허만료는 ‘23년이나 최대 매출은 그 보다 앞선 ‘18년(오젬픽 등장)에 $3.9bn를 기록하고, 지속 하락세를 이어왔다. 반면, 편리성을 갖춘 1주 1회 투여의 오젬픽은 출시 5년만인 올해 $12.4bn(YoY +46%)가 전망된다. 1주 1회 투여 외에도 편의성 측면에서 개발이 가장 앞서있는 것은 경구 제형이다. 당뇨병 치료제로 노보 노디스크의 리벨서스가 1일1회 최대 14mg으로 2019년에 GLP-1 경구용 세계 최초로 출시되었다. GLP-1 당뇨병 프랜차이즈 내에서는 ‘22년 기준 14%의 점유율을 차지하며, 지난해 매출액 $1.6bn(YoY +111%)을 기록하였다. 1주1회 제형의 오젬픽의 매출 성장세 높았기 때문에 경구 제형이 주사제를 대체할 것이라는 기대감이 굉장히 높으나, ‘28년 GLP-1 주요 치료제 중 경구용의 매출 비중은 24%로 주사제를 전부 대체할 것으로 보이지는 않는다(빅토자, 오젬픽, 리벨서스 합산 기준). 1주1회 투여인 오젬픽은 ‘22년 비중 72%에서 ‘28년 75%로 경구제형 등장에 따른 비중 영향은 미미할 것으로 전망되고 있다.  경구 제형, 주사제 완전히 대체 당분간 어려울 것 경구 제형의 낮은 생체 이용률과 수익성 등으로 지속형 주사제에 대한 수요는 사그라지지 않을 것으로 판단된다. GLP-1 세계 최초 경구제 리벨서스는 GLP-1 유사체가 위장관을 통해 약물이 흡수될 수 있도록 흡수 증강제인 SNAC(sodium N-(8-[2-hydroxybenzoyl] amino)caprylate)을 결합하였다. 그럼에도 불구하고 생체 이용률(BA, Bioavailability) 1% 이하이며(vs 오젬픽 89%), 흡수와 효능을 최대화 하기 위해 공복상태에서 약물을 복용하고 이후 최소 30분 동안 아무것도 먹거나 마시지 않는 것이 좋다. 또한, 다른 경구 의약품을 복용하기 전 최소 30분을 기다려야한다. 오젬픽은 하루 중 언제든지 주사 가능하다. 용량도 높아 주사제 대비 수익성이 낮을 것으로 추측된다. 오젬픽은 1주1회 투여에 0.25~0.5mg 부터 늘릴 수 있는 반면, 경구제형인 리벨서스는1일1회 투여로 처음 3mg부터 시작하여 7mg, 14mg로 순차적으로 올라간다. 오젬픽과 리벨서스의 한달치 약가는 약 $900 대로 유사하다(GoodRx 기준). 비만 치료제로는 용량이 더욱 높아, 경구제 크기가 크며 수익성은 낮을 것으로 추측된다. 지난 5월 발표된 50mg 용량 경구용 세마글루타이드를 비만 환자 667명 대상으로 한 3상에서 68주 후 평균 15.1% 체중 감소 하여 주사제 위고비(SC제형 2.4mg 1주1회 68주차 14.9% 감소)와 유사한 효능을 나타내었다. 주사에 대한 거부감이 있는 환자들에게는 경구 제형이 필요하나, 경구제 크기, 낮은 생체 이용률과 수익성 등으로 피하제형 주 사제를 완전히 대체하기는 당분간 어려울 것으로 판단된다. 그럼에도 불구하고 경구제에 대한 다국적 제약사들의 개발은 지속 이어지고 있다. 화이자는 지난 6월 경구용 비만/당뇨 치료제 로티글리프론(1일1회 복용) 개발을 중단하였다. 임상시험 참가자들의 간 관련 증상이나 부작용을 겪지는 않았으나, 간 효소 수치 상승이 확인됨에 따라 경구용 치료제 개발 계획을 폐기하기로 결정한 것이다. 다만, 다른 경구용 비만치료제 다누글리프론(1일2회 복용) 2b상 개발에 집중하겠다고 밝히며, 올해 말경 2b상이 종료될 수 있을 것으로 예상하였다. 다누글리프론에 참여한 1,400여명의 피험자의 경우 아미노기 전이효소 수치의 상승이 관찰되지 않았다. 반면, 릴리는 지난 미국 당뇨학회(ADA)에서 경구용 당뇨/비만 치료제 오포글리프론 긍정적 2상을 발표하였다. 당뇨 관계 없이 비만 환자 272명(평균 108.7kg, BMI 37.9/m2) 대상으로 치료 26주째 체중 감소율이 8.6~12.6%(vs 위약 2%)을 기록하였고 36주째에는 9.4~14.7%(vs 위약 2.3%)을 달성하였다(최대용량 45mg). 가장 흔하게 보고된 이상반응은 위장관계로 대부분 경도~중등도 수준이었고, 용량 증량 단계에서 발생하였다. 올포글리프론은 3상 진입하여, 2025년 결과 공개될 예정이다.   따라서 경구 제형 개발은 지속될 것으로 보이나, 일1회에서 주1회로 투여 주기가 길어진 트렌드 또한 지속 이어질 것으로 전망된다. Amgen의 1개월 1회 제형의 항체 펩타이드 컨쥬게이트 비만 치료제 AMG133 1상 발표 당일 시가총액 $9bn 증가하며, 떠오르는 비만 경쟁자가 되었고 1개월 제형의 전쟁은 이미 시작되었다. 선두업체인 노보와 릴리 역시 1개월 제형 변경 플랫폼 개발에 뛰어들지 않을 수 없다고 판단된다. 국내에서는 펩트론이 스마트데포 기술 기반의 지속형 펩타이드 플랫폼을 보유하고 있으며, 탑티어 글로벌 제약사로 추정되는 업체와 기술 이전 전 단계인 Term Sheet를 수령한 바 있다. 인벤티지랩 또한 국내 대형사와 기술 이전 논의가 진행되고 있다고 알려졌으며, 비상장사 지투지바이오는 장기 지속형 주사제 기술을 보유하고 있으며 글로벌 업체와 기술이전 논의하고 있는 것으로 알려졌다. 이 밖에도 디앤디파마텍의 전임상 단계의 GLP-1 경구제 2종을 계약금 130억원, 총 5,500억원에 기술 이전 한 바 있다. 라파스는 대원제약과 공동 개발하여 마이크로니들 패치 비만 치료제 DW-1022(세마글루타이드 패치제) 국내 1상 IND 신청한 바 있다.  신약 부문에서는 GLP-1 작용제를 기반으로 한 비만 치료제가 일시적 트렌드가 아닌 글로벌 메가 트렌드로 자리 잡고 있으며, 올해 하반기 학회 및 다수의 데이터 발표와 ‘24 년에 적응증 확장 데이터 발표 등이 이어지며 모멘텀이 이어지겠다. 관련하여 1 개월 제형 변경 플랫폼을 보유한 펩트론이 글로벌 제약사와 기술 이전 논의 중이며, 인벤티지랩은 국내 대형 제약사로 기술 이전이 기대된다. |
* ADA(미국 당뇨학회) 2023 후기 | 당뇨 치료제 동향 (2023.07.27)
https://www.youtube.com/watch?v=OJ_SAMrDBw4
* ’제2의 셀트리온‘ 조만간 나타난다! 제약·바이오주 트렌드, 항암제에서 당뇨·비만치료제로 넘어가는 중 (ft. 허혜민 키움증권 연구원) (2023.07.19)
https://www.youtube.com/watch?v=tExnvIMLp9I
* [펩트론] GLP-1 전쟁의 캐스팅보트 - 키움증권 (2023.07.18)


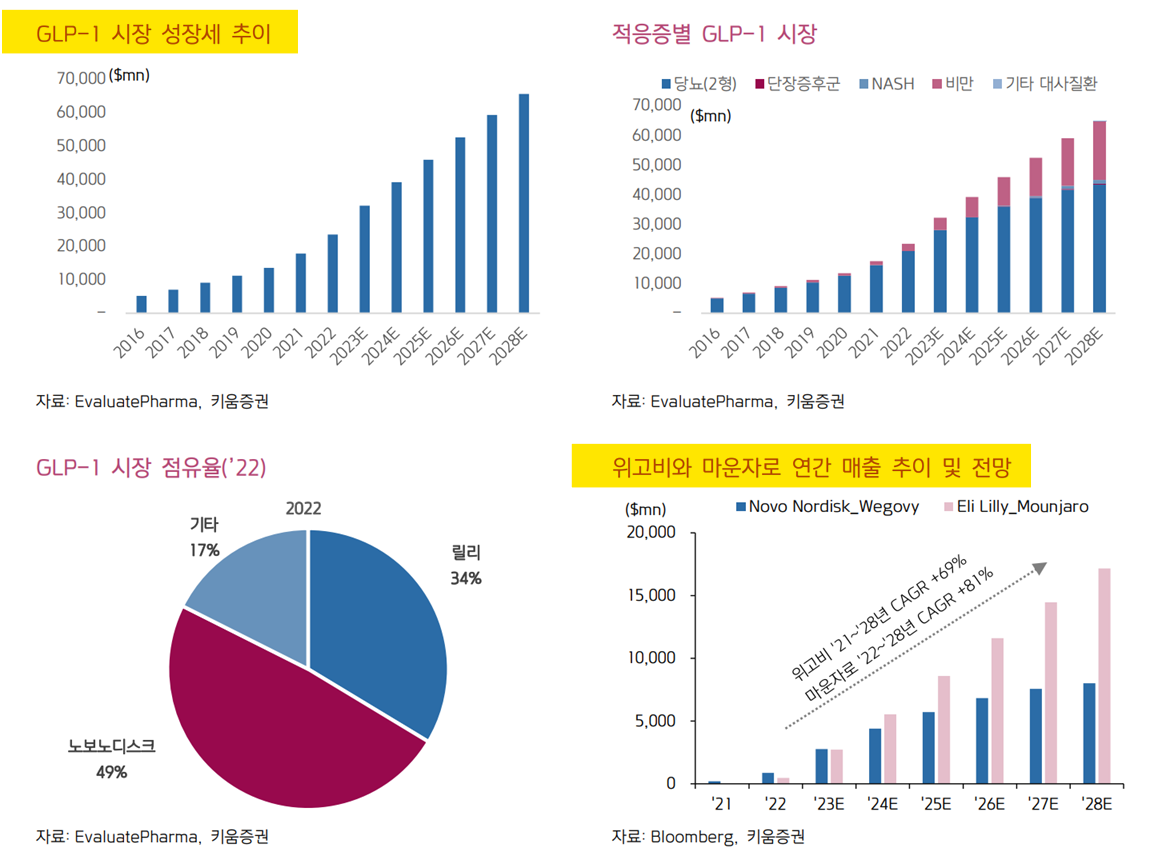

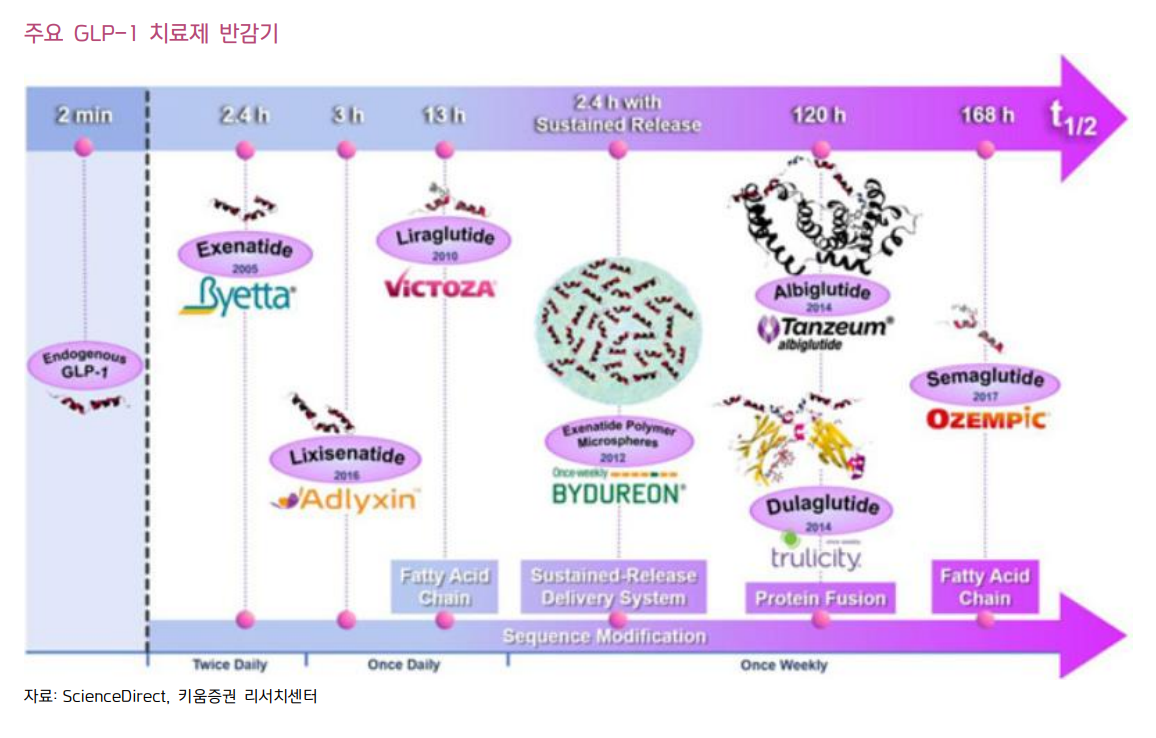

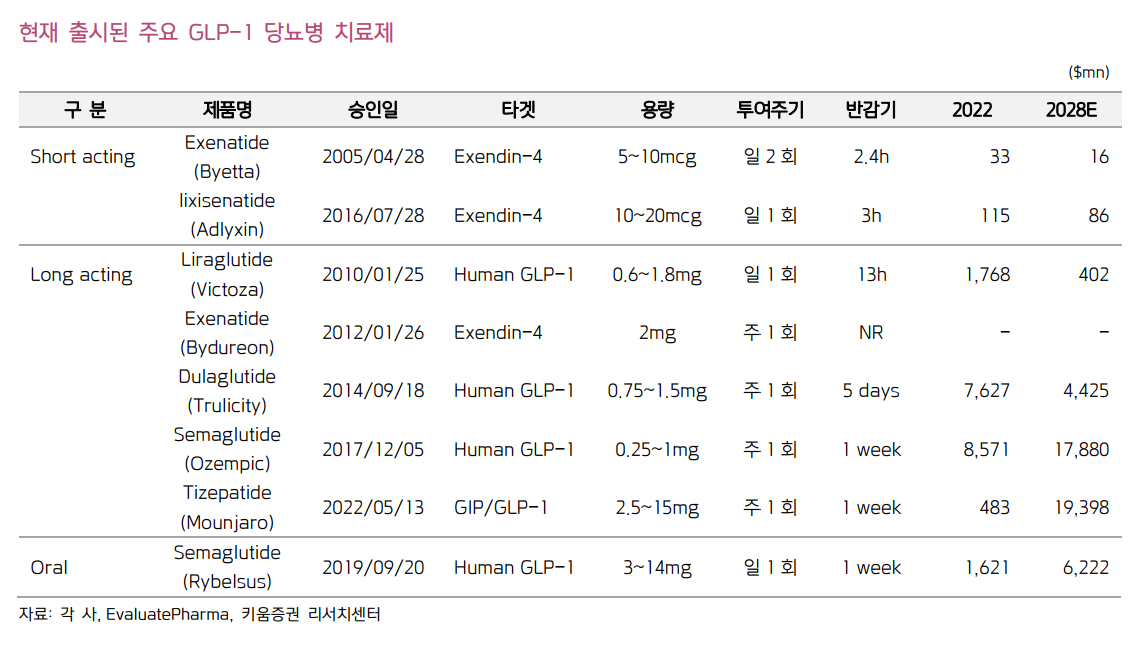

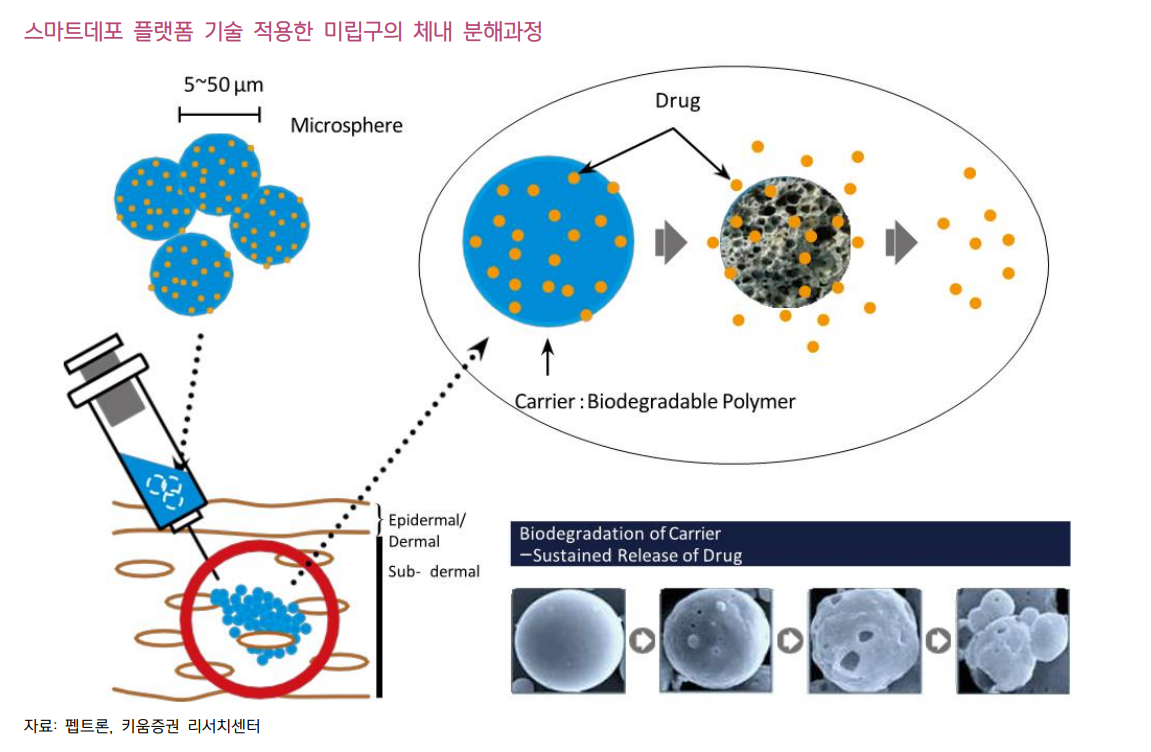
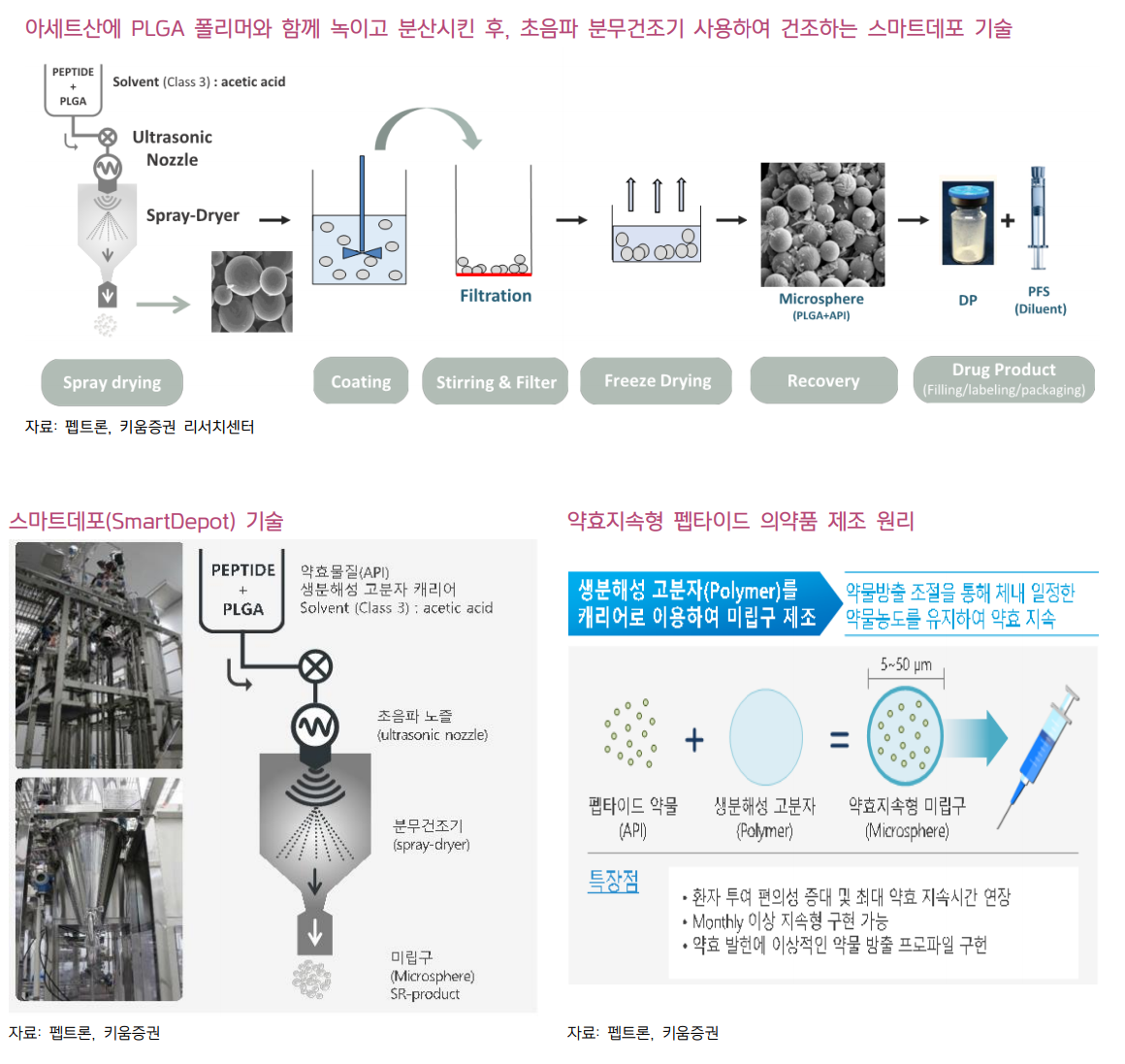
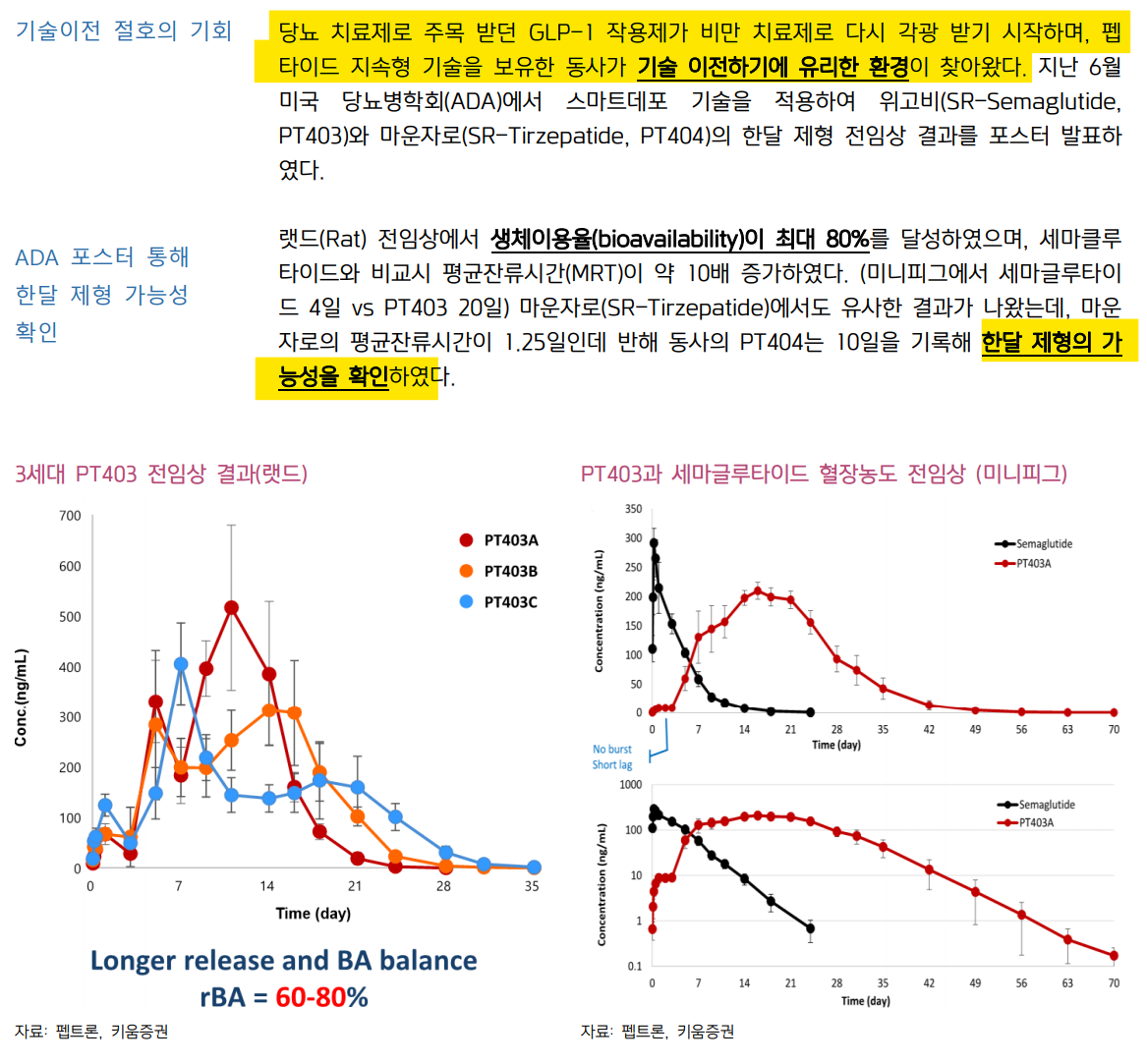

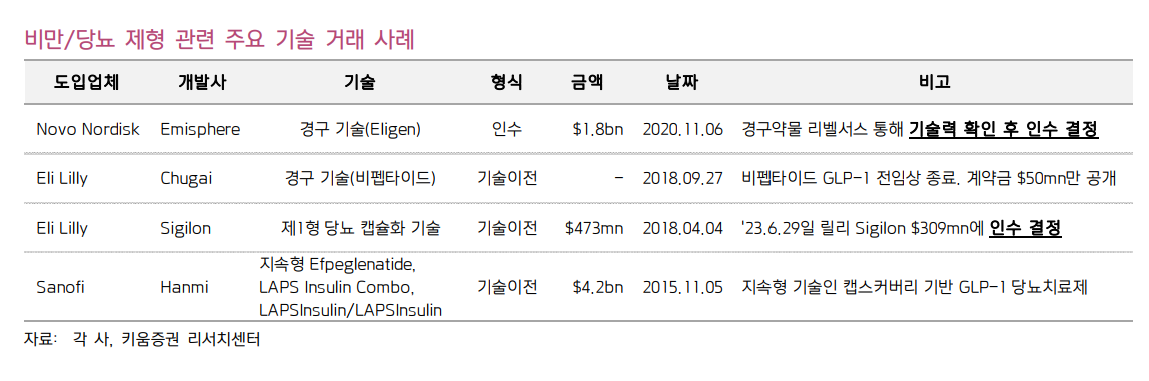
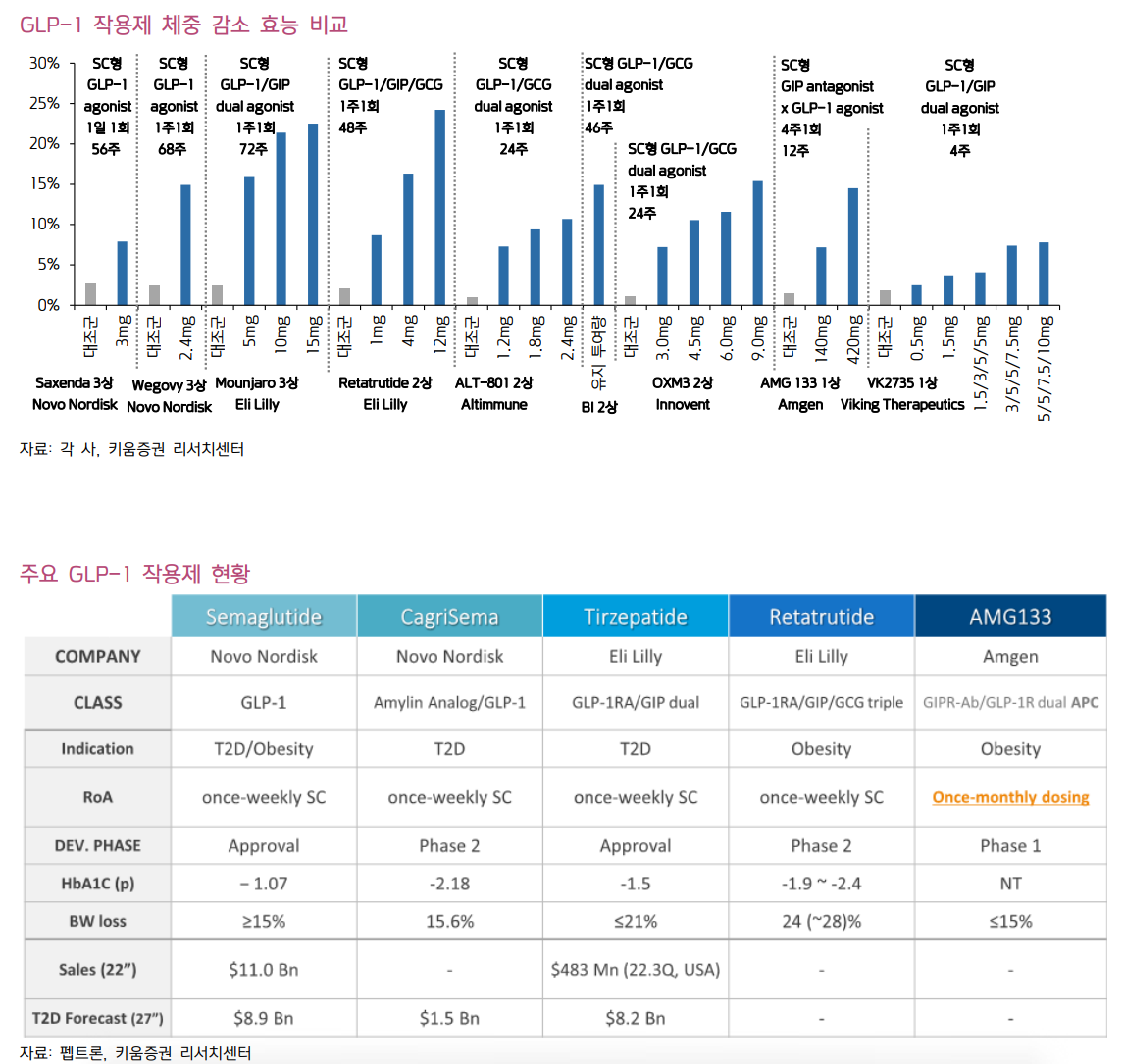



* 펩트론 IR Book (2023.07.17)
* [펩트론] 노보노디스크, 일라이 릴리도 원하는 기술을 가지다. (2023.07.15)
https://blog.naver.com/riamunger/223156922748
* 펩트론 - 다국적사가 선택할 수 밖에 없는 이유 - 키움증권 (2023.07.04)
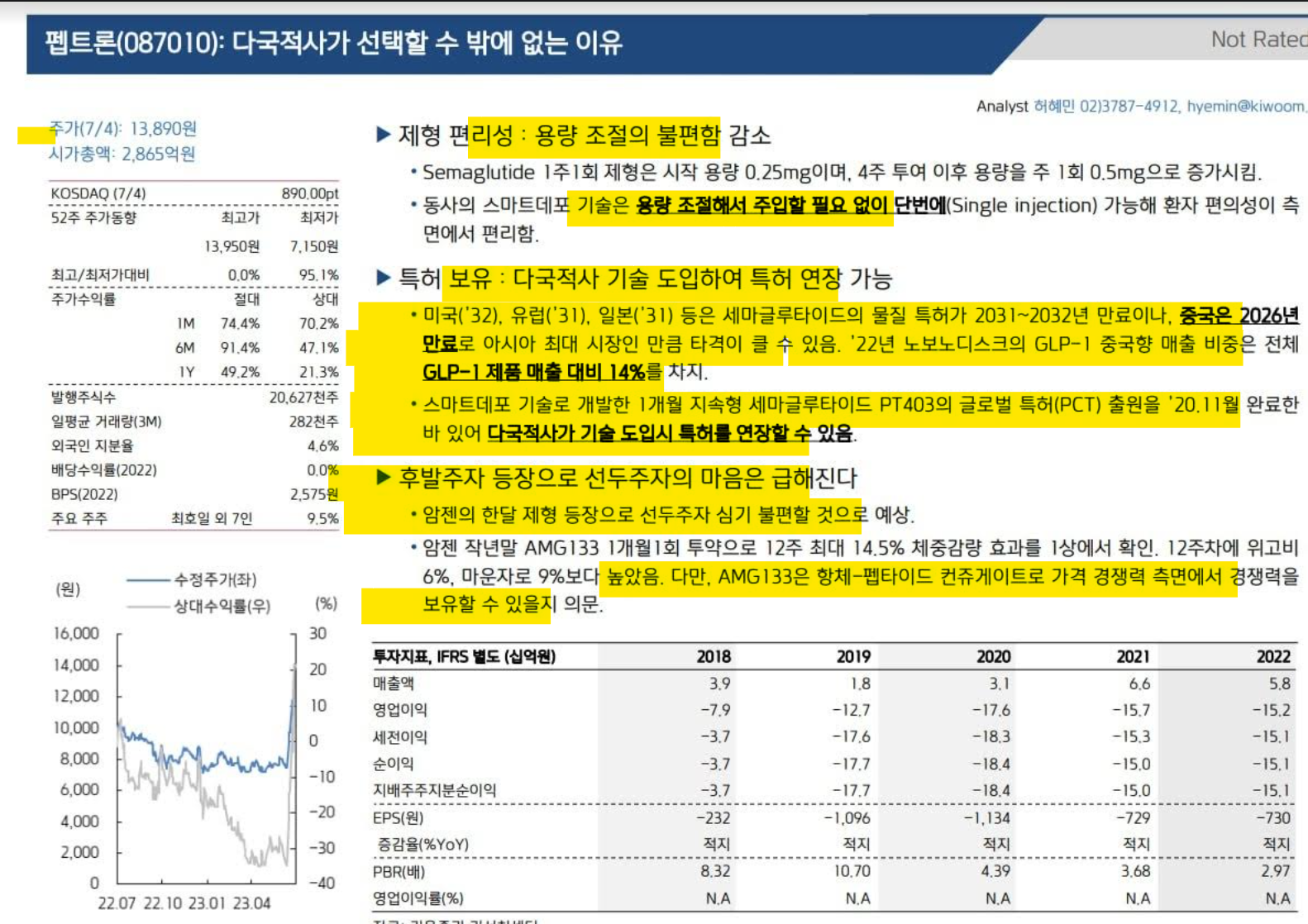
* 펩트론 홈페이지 (2023.06.29)

* 펩트론 키움증권 리포트 - 나를 다시 보게 될 거야 (2023.06.22)
https://ssl.pstatic.net/imgstock/upload/research/company/1687389755027.pdf
| 비만 치료제 제형 경쟁으로 관심 이동 전망 릴리의 당뇨/비만 치료제 마운자로가 3상에서 72주째 투여한 15mg군에서 평균 체중 감소율이 22.5%를 기록한 바 있다. 100kg 환자의 경우, 이는 충분한 체중 감량이기 때문에 체중 감소 효과를 더 높이는 경쟁 보다는 편의성 측면에서 소비자 접근성이 유리한 제형 변경 경쟁으로 이동할 것으로 보인다. 6/20일 미국당뇨병학회(ADA)에서 동사의 스마트데포 기술을 활용한 월1회 또는 2개월에 1회 제형으로 위고비(Semaglutide, PT403) 및 마운자로(Tirzepatide, PT404)의 지속형제제 전임상 데이터 초록이 공개되었다. 단일 GLP-1 유사체 뿐만 아니라 이중 작용제에도 현재 1주1회 제형에서 월1회 제형으로의 가능성을 전임상에서 확인하였다. 또한, 당뇨/비만 치료제에서 앞서 가고 있는 주요 경쟁 업체의 2개 물질을 모두 시험하였다는 점에서 기술 수출 협상력이 높아질 것으로 추측된다. 동사는 지난 ’22.12월 당뇨 분야 글로벌 탑레벨 대형제약사와 1개월 지속형 당뇨병 치료제 관련하여 물질이전계약(MTA)를 체결했다고 밝힌 바 있다. 1개월1회 제형의 비만 치료제는 암젠의 AMG133(GLP-1/GIP)이 1상 중이며, 12주째 투여 고용량(420mg)에서 14.5%의 체중이 감소하였다. 위고비 2.4mg, 마운자로 15mg 대비 용량이 높고, 항체-펩타이드 컨쥬게이트(Bispecific antibody-peptide conjugate)로 높은 원가로 추정되어 가격 측면에서 경쟁력이 떨어질 수 있다. 스마트데포 그 동안 발전이 있었다 동사는 ’18.12월 약 200억원을 투자하여 오송에 1공장을 완공하였다. 그 동안 EU GMP 인증을 획득하였고, Invex와 스마트데포 기술 적용하여 공동개발하는 지속형 엑세나타이드 프리센딘(특발성 두개내고혈압)이 글로벌 3상 승인 받아 임상용 의약품이 처음으로 미국에 진출하게 되었다. 해외 진출을 위한 준비가 잘 되어 있다는 점 또한 과거 대비 기술 이전 진행을 하는 데에 있어서 긍정적으로 작용할 것으로 추측된다. 이 밖에도 스마트데포 기술 적용한 전립선암 치료제 PT105 생동성 임상 성공하였으며, 국내 판매 파트너사와 판권 계약이 기대된다. 다만, 동사는 1분기말 기준 현금성자산이 약 140억원이며, 지난해 영업손실 152억원을 기록하였기 때문에 연내 기술 이전되지 않는다면 운영 자금 마련이 필요할 것으로 보인다.  |
* 펩트론 홈페이지 - 바이오 USA 참가 결과 안내 (2023.06.12)

* 펩트론 첫 상용화 제품 생산기지를 가다...‘비상 준비 이상무’ (2023.02.22)
https://pharm.edaily.co.kr/news/read?newsId=01334966635513144
| “올해 첫 상용화 제품을 이곳 충북 오송 펩트론 공장에서 생산한다. 창립 25년, 공장 건립 4년 만의 쾌거다. 국내뿐만 아니라 유럽 의약품제조 및 품질관리기준(GMP)도 충족해 글로벌 시장으로 나갈 제품도 직접 만들어 직원들이 자랑스러워한다.” 지난 10일 오송 공장에서 만난 조훈희 펩트론 생산팀장은 자부심 가득한 목소리로 이처럼 강조했다. 오송 공장은 펩트론이 200억원을 투자해 2018년 12월 완공했다. 최대 생산 가능량은 연간 100만 바이알이다. 임상 시료 및 상업 제품을 생산할 수 있는 GMP 공장으로 국내 벤처 제약·바이오사 중 이 같은 시설을 갖춘 곳은 손가락에 꼽는다. 1개월 지속형 전립선암 치료제 하반기 본격 생산 예정 지난해까지는 임상시험용 시제품 등을 주로 생산했다. 하지만 올해 하반기부터는 펩트론의 첫 상용화 제품을 본격적으로 양산할 예정이다. 1개월 지속형 전립선암 치료제 ‘PT105’가 주인공이다. 펩트론은 이미 복수의 국내외 제약·바이오사와 PT105의 품목허가 일정, 현지 판매 전략 등 세부적인 전략을 조율하고 있다. 조 팀장을 비롯해 이날 만난 직원들의 얼굴에 생기가 가득했던 이유이기도 하다. 조 팀장은 “PT105는 국내외 1개월 지속형 전립선암 치료제 시장의 ‘게임체인저’가 될 수 있을 것”이라며 “의약품 위탁생산(CMO) 제품, 특발성 두개 내 고혈압(IIH) 치료제 ‘PT320’ 등과 함께 펩트론의 ‘캐쉬카우’(현금 창출원)로 자리매김할 것”이라고 말했다. 펩트론이 PT105의 성공을 자신하는 배경은 제품의 시장성이다. PT105는 글로벌 제약사 다케다의 류프로렐린 성분을 활용한 오리지널 제품(원제품) ‘루프린’의 제네릭(복제약)이다. 루프린은 1989년 출시 후 30년이 넘도록 세계 시장 점유율 1위를 기록하고 있는 대표적인 블록버스터 의약품이다. 업계에 따르면 지난해 국내 루프린 1개월 제형 시장은 600억원(오리지날 150억원+제네릭 450억원) 규모로 추정된다. 글로벌 루프린 시장은 약 2조 7000억원 규모다. 한국뿐만 아니라 유럽 GMP 인증도 완료..최신 설비 완비 이날은 올해 PT105 등 주요 제품의 생산을 앞두고, 재정비를 위해 공장을 일시 가동중지한 상황이라 직접 내부도 들여다볼 수 있었다. cGMP 시설은 제품의 안전성과 균일성 등을 위해 외부인의 출입을 철저히 통제한다. 이날 가동중지 상태의 공장을 둘러보기 위해서도 몇 겹의 보호복 껴입기를 공정별로 반복해야 했을 정도였다. 견학은 제품 원료가 들어오는 것부터 시작해 완제품이 돼 나가는 공정까지 순차적으로 이뤄졌다. 유리창으로 통해 둘러봐야 했지만, 원료칭량과 조제-제균여과-분무건조-인라인믹서-동결건조기-분쇄기-충전과 캡핑-기밀도 시험 등의 과정이 얼마나 정밀하게 이뤄지는지 쉽게 알 수 있었다. 한편으로는 그 어떤 장소보다 통제된 공정 속에서 일하시는 분들의 노고에 감사한 마음이 생겼다. 가장 인상적이었던 곳은 분무건조실이었다. 오송 공장에서 가장 중요한 공정을 담당하는 곳으로 설비도 가장 컸다. 높이 약 3m, 폭 2m의 분무건조기 2기가 분무건조실을 꽉 채우고 있었다. 기당 약 15억원에 달하는 분무건조기에 맞춰 공장도 설계됐다. 조 팀장은 “오송 공장은 국내에서 몇 안 되는 분말형 바이오 제품을 생산할 수 있는 곳으로 핵심 역할을 분무건조기가 담당한다”며 “이와 함께 0.1mg 단위까지도 조절하는 약 30억원의 분말충전기 등이 우리 공장의 핵심”이라고 전했다. 2028년께 연매출 1000억 기대..‘증설 준비 중’ 견학을 마치고, 다시 현관으로 돌아오자 처음에 미처 보지 못했던 연구실이 눈에 들어왔다. 통창으로 이뤄진 연구실에는 그 중요하고 비싸다던 분무건조기 등이 똑같이 설비돼 있었다. 대부분 제약·바이오 연구실과는 차별화되는 점이기도 했다. 하지만 연구실에 이런 고가의 장비가 필요한지 의아해 질문을 던졌다. 그는 “생산본부로 기술이전을 하는 목적한 DDS(Drug Delivery System)연구센터로 동일한 장비를 사용함으로써 제조 재현성의 용이성을 높이고 있다”며 “이 덕분에 생산공정으로 기술이전 후에도 큰 오류가 없어 오히려 비용이 절감된다”고 설명했다. 펩트론은 PT105와 PT320 등이 5년 내 시장에서 자리 잡을 수 있을 것으로 보고 있다. 현실화되는 2028년께에는 연매출액 1000억원도 무난히 확보할 수 있을 것으로 전망한다. 이를 위해서는 기존 공장의 증설이 필수다. 이미 공장 주변에 부지를 확보해 둔 상태로 조만간 건설을 위해 첫 삽을 뜰 계획이다. 조 팀장은 “펩트론은 기술개발뿐만 아니라 상업화 제품의 생산도 가능한 국내에 몇 안 되는 제약·바이오 벤처”라며 “PT105와 PT320 등의 상업용 제품을 통해 K-바이오의 저력을 보여줄 것”이라고 강조했다. |
* 펩트론, 뇌질환 치료제 '프리센딘' 유럽식약처 소아청소년 임상 승인 (2023.01.23)
http://www.newsprime.co.kr/news/article/?no=589581
| 펩트론(087010)은 호주 인벡스(Invex Therapeutics)와 공동개발 중인 특발성 두개 내 고혈압 치료제 후보물질 '프리센딘(Presendin)'이 유럽식약처(EMA)로부터 소아청소년 대상 임상 계획을 승인받았다고 3일 밝혔다. 인벡스는 펩트론이 독자 개발하고 완제의약품까지 자체 생산하고 있는 PT320을 특발성 두개 내 고혈압(Idiopathic Intracranial Hypertension, 이하 IIH) 치료제로 개발하기 위해 글로벌 3상 임상을 진행 중이다. 임상은 영국, 미국, 호주, 이스라엘, 뉴질랜드 등 전세계 40개 기관에서 진행되고 있으며 지난 11월부터 환자 투여가 개시됐다. 유럽식약처(EMA)는 프리센딘의 소아청소년 대상 임상 계획을 새롭게 승인했다. 이로써 기존 주환자군이 18세 이상 성인에서 12세 이상의 청소년기부터로 조정됐으며, 이는 PT320의 안전성을 규제당국이 확대 인정한 결과이다. 펩트론 관계자는 "인벡스는 시장확대를 위한 전략으로 치료환자 군을 확대하고 있으며, 그 계획의 일부가 실현된 것"이라며 "환자군 확대에 따른 전체 시장확대로 펩트론이 기대되는 매출이 크게 증가할 것으로 기대된다"고 말했다. 업계에 따르면 IIH치료제 시장 규모(유병률기준)는 미국과 유럽만 약 2조원 규모로 추산되며, 매년 3.4% 이상 성장하고 있는 것으로 알려졌다. '프리센딘'은 미국과 유럽으로부터 희귀의약품(ODD)으로 지정돼 각각 7년, 10년 동안 독점판매자격을 확보한 상태다. 펩트론은 향후 관련 수익만 10년간 5000억원 이상으로 전망하고 있다. 한편, 펩트론은 동일 물질의 PT320으로 파킨슨병 치료제를 개발하고 있다. 최근 확인한 임상2a상에서 결정된 약물 용량과 치료 효과에 대한 결과를 바탕으로 임상 프로토콜을 조정하여 효력 확증을 위한 확대 임상을 진행할 예정이다. |
* 펩트론, 임상 2a상서 파킨슨병 치료 효과 확인…통계적 유의성은 '미흡' (2022.12.21)
https://m.mdtoday.co.kr/news/view/1065603221130718
| 펩트론은 지난 2년간 진행한 임상 2a상에서 파킨슨병의 치료 효과를 확인했으나 1차 유효성 평가변수의 통계적 유의성 확보에 미흡했다고 21일 공시를 통해 밝혔다. 이번 임상은 뇌질환 치료제로 개발중인 PT320의 유효성과 안전성을 평가하고 치료 용량을 확정하기 위한 목적으로 서울대학교병원과 서울아산병원, 삼성서울병원 등 총 5개 병원에서 초기 파킨슨 환자를 대상으로 실시됐다. 임상 시험의 1차 유효성 평가변수인 UPDRS part 3 score(파킨슨병의 운동 증상을 평가하는 지표) 결과, 위약군에서는 증상이 악화된 반면에 PT320 2.5mg 투여군에서 증상 개선 효과가 확인됐으나 통계적 유의성을 입증하지는 못했다. 그러나 2.5mg 투여군 내의 운동 증상 개선에 대한 p-value(유의 확률)은 FAS 분석군(투여가 시작된 모든 대상자) 32명에서 p=0.0696, PPS 분석군(임상 프로토콜을 준수한 대상자) 27명에서 p=0.0517로 나타났다. 2차 유효성 평가변수에서는 K-PDQ-39 score(일상생활능력 등 삶의 질을 평가하는 지표)의 이동성 평가에서 위약군 대비 개선이 확인됐으며, 군 간에 통계적으로 유의한 차이를 보였다. 안전성 평가에서는 모든 용량에서 약물이상반응 등 임상적으로 유의할 만한 부작용이 없음을 확인해 PT320의 안전성을 입증했다. PT320 2.5mg 투여군에서는 임상 전체 기간 동안에 복용한 증상완화제 레보도파 약물의 증가 폭이 위약에서 보다 낮아진 효과가 나타났다. 또한 48주 간의 투여 종료 후 12주 동안 진행된 추적 관찰에서는 최종 60주 시점까지 UPDRS part 3 score 변화량으로 평가한 운동 증상 개선 정도가 위약보다 높게 유지됨에 따라 약물의 투여를 종료한 이후에도 PT320에 의한 증상 개선이 지속되는 치료 효과가 있는 것을 확인했다. 특히, 초기 파킨슨 환자 중 증상이 심한 중증도 환자군(H&Y stage 2.0 이상)을 대상으로 분석한 치료 효과는 통계적 유의성을 충족한 결과로 나타났다(p=0.0110). 회사 측은 이번 임상 결과로 PT320의 인슐린 저항성 개선 작용기전이 뇌세포의 회복과 활성화를 통한 퇴행성 뇌질환의 근본적인 치료 원리가 될 수 있는 가능성을 확인했다고 보고 아직까지 이렇다 할 성공적인 치료제가 나오지 못하고 있는 파킨슨병의 치료제 개발을 향한 도전을 멈추지 않을 계획이다. 임상 자문위원으로 임상 디자인에 참여한 영국 유니버시티 칼리지 런던(UCL)의 폴티니 교수와 미국 메이요 클리닉 의대 신경정신과의 최두섭 교수는 “이번 임상에서 소규모의 임상 환자 수와 자가 투여로 인한 복약순응도 저하, 레보도파 병용 허용에 따른 위약군과의 증상 차이 감소 등으로 인해 통계적 유의성 확보에 아쉬운 결과가 나타난 것으로 보인다”며, “환자 수 증가 및 투여가 편리한 프리필드 시린지 도입 등으로 일부 임상 프로토콜을 보완해서 통계적 유의성 확보와 성공 가능성을 더욱 높일 수 있을 것”이라고 전했다. 회사 관계자는 “본 임상시험이 용량 선정을 위한 임상 2a상이라는 점에서 후속 임상을 위한 타당한 과학적 근거가 마련된 결과”라고 평가하고 “이를 바탕으로 현재 기술이전을 추진 중인 해외 파트너 사들과 허가용 글로벌 임상 진입에 대한 논의를 진행할 예정”이라고 밝혔다. 한편, PT320은 펩트론의 스마트데포 기술로 약효지속시간을 30배, BBB(뇌혈관장벽) 투과율을 20배 이상 증가시킨 서방형 펩타이드 약물로 미국 국립보건원과 함께 퇴행성 뇌질환 치료제로 개발 중이다. |
* "매출로 말하겠다" 펩트론, 내년 외형성장 '본격화' 자신 (2022.12.14)
http://www.newsprime.co.kr/news/article/?no=587844
| 펩트론의 강점은 '한 번의 주사로 환자의 고통을 줄이는 '롱액팅(약효 지속) 제조 기술이다. 쉽게 말해 여러 번 투여해야하는 주사제를 한 번의 투여로 해결하는 것이다. 이는 '편안하게(고통없이) 치료한다'는 의미의 회사 슬로건인 '코지큐어(CozyCure)'에서도 알 수 있다. '구슬이 서 말이라도 꿰어야 보배'이듯, 이러한 가치의 대외적인 인정과 수익 창출을 위해선 실행력이 필요하다. 이러한 '실행력'을 반증하는 것이 오송바이오파크 공장이다. 해당 공장은 주사제 완제의약품을 연간 100만 바이알 규모로 생산할 수 있는 규모를 자랑한다. "저희 기술은 '가능성'만으로도 인정받는 일반적인 신약 개발과 달리 생산 기술이 더 큰 비중을 차지합니다. 대량생산을 통한 '증명'이 필수라는 의미입니다. 상장 초기에는 공장에 대한 생각 없이 진행할까 고민도 했고, '바이오 벤처로써는 이르다'는 주변의견도 많았습니다. 하지만 회사 발전을 위한 원동이라고 판단, 지금에 이르게 됐습니다" 펩트론은 올해 '약효 지속성 기술의 실현화'라는 이정표를 완성했다. 직설적으로 표현하자면, 단순히 기술력을 뽐내는 것에서 나아가 확실한 외형성장의 기틀을 만들었다는 것이다. 가장 눈여겨 볼 것 중 하나는 1개월 지속형 제네릭 의약품 PT105다. 전립선암 치료제 PT105는 국내 최초이자 일본을 제외한 세계 최초로 생물학적 동등성(BE) 확보에 성공했다. 이를 통해 내년부터 판권계약을 체결을 통한 본격적인 상업화가 가능하게 됐다. PT105의 오리지널 의약품인 다케다의 루프린(성분명 류프로렐린)은 1989년 출시 후 30년이 넘도록 세계 시장 점유율 1위를 기록하고 있는 대표적인 블록버스터 의약품이다. 이에 국내외 유수 제약사들이 도전했지만 성공 사례는 없었다. 펩트론은 자사의 스마트데포 기술을 적용해 루프린과 1개월 지속 방출 패턴까지 동등하도록 구현하는 것에 성공했다. 업계에 따르면 지난해 기준 국내 류프로렐린 3.75MG 시장은 약 600억원으로 추산되고 있다. 이중 제넥릭 의약품은 약 450억원으로 알려졌다. '퓨어 제네릭 의약품'이라는 강점을 지닌 PT105가 빠르면 내년 품목허가 후 최소 연간 100억원 이상의 매출이 예상되는 이유다. 이에 더해 글로벌 시장 점유 확대를 위한 3·6개월 제형 개발을 통해 확실한 캐시카우(수익창출원) 자리를 굳힌다는 계획이다. 펩트론의 외형성장을 견인할 또 다른 파이프라인은 당뇨병 치료제 PT403이다. 2020년 11월 글로벌 특허출원을 완료한 PT403은 세계 최초의 1개월 지속형 당뇨치료제 출시·사업화를 목전에 두고 있다. 현재 당뇨 치료제로 가장 널리 알려진 것은 인슐린이다. 인슐린은 투여 시 바로 혈당을 낮춰주는 효능을 지니고 있다. 다만, 한 번 투여하면 평생 자주 투여해야한다. 환자 입장에선 거부감이 들 수밖에 없다. 인슐린 자체로서 치료 효과를 기대하기 어렵다는 단점도 있다. 인슐린을 지속 투여 시 살이 찐다는 부작용 사례도 종종 나오고 있다. 펩트론이 개발 중인 PT403은 GLP-1을 기반으로 한다. GLP-1은 당을 조절하는 데 관여하는 펩타이드 물질로, 몸에 당이 필요할 때 인체에 인슐린 분비를 명령하는 호르몬이다. 위장에도 관여해 식욕을 떨어뜨리는 작용 기전도 갖고 있다. 외국의 경우, 당뇨를 앓는 환자 중 고도 비만을 겪고 있는 비율이 높아 더 효과적이다. 이러한 효과로 인해 GLP-1 계열 펩타이드 당뇨치료제는 인슐린을 능가하는 차세대 당뇨 치료제로 각광받고 있다. 현재 당뇨병 치료제 글로벌 시장 규모는 1주 지속형 제품 3종과 1일 지속형 제품 1종을 포함해 총 30조원 정도다. 펩트론의 한 달 지속형 제품이 출시되면 업계의 게임 체인저가 될 것이라는 관측이 지배적이다. 현재 시장의 일부만 선점하더라도 조 단위 시장을 손에 넣게 된다. |
* 펩트론, 1개월 지속 당뇨병 치료제 글로벌 빅파마와 MTA 체결 (2022.12.02)
https://www.pharmnews.com/news/articleView.html?idxno=216006
| 펩트론은 당뇨 분야 글로벌 탑 레벨 대형제약사와 1개월 지속형 당뇨병 치료제 상업적 개발을 위한 물질이전계약(Material Transfer Agreement, 이하 MTA)을 체결했다고 22일 밝혔다. 펩트론에 따르면 지난 수개월 동안 진행된 글로벌 제약사 기술 자료 평가에서 상업화에 요구되는 성능과 조건을 충족하는 결과를 도출하고, 이를 기반으로 글로벌 제약사 우선 협상 대상으로 선정되며 MTA를 체결하게 됐다. 앞으로 상대 제약사는 펩트론 스마트데포 기술로 개발한 1개월 지속형 세마글루타이드 PT403 효능 직접 검증을 진행할 예정이다. 회사 측은 통상적인 MTA 체결과는 다르게 지난 수개월 동안 여러차례에 걸친 상호간 고위급 회의(scientific meeting)를 통해 기술과 물질에 대한 공감대가 형성돼 1,2가지 검증만으로 검증이 종료될 예정이라 설명했다. 이는 짧은 시간에 평가가 종료 될 수 있다는 의미다. 펩트론 당뇨병 치료제 PT403은 제형 확정 및 실험을 통해 데이터를 확보한 상황으로 2020년 11월 글로벌(PCT) 특허 출원을 완료했다. 이를 통해 PT403은 기존 세마글루타이드 1주 제형 대비 약 6배 이상 지속된 약동학적(PK) 프로파일을 확인했으며 세마글루타이드 임상결과와 유사한 체중감소 효과를 확인했다고 회사 측은 밝혔다. 펩트론 관계자는 " GLP-1 당뇨 및 비만치료제는 1일 2회 주사제에서 1주 지속형까지 발전한 이후 1개월 이상 지속형에 대한 시장 기대가 매우 높아져 있지만 고용량으로 인한 부작용의 증가와 약효 지연 현상 때문에 기존 기술로는 더 이상 개발이 어려워진 상황"이라며 "약물 방출 농도를 제어할 수 있는 스마트데포 기술력으로 기존 한계를 극복했다"고 전했다. 이어 "당사가 환자 투여가 진행 중인 검증된 생산 공정과 GMP 시설을 확보하고 미국 FDA 3상 승인을 획득한 스마트데포기술을 적용했다는 점이 이번 계약에서 높은 이점으로 작용했다"며 " MTA를 체결한 해당 글로벌 제약사가 당뇨병 치료제 시장에서 입지를 고수하기 위해 빠른 시일 내 기술 검증을 마치고 상용화 진행을 추진하고 있으며 당사는 이에 대한 모든 준비가 돼 있다"고 덧붙였다. |
* 펩트론,글로벌 제약사와 당뇨약 MTA에 2개월 장기지속형 후보 추가 (2022.12.09)
https://www.pharmnews.com/news/articleView.html?idxno=216321
| 펩트론(대표이사 최호일)이 글로벌 대형제약사와 체결한 물질이전계약(Material Transfer Agreement, 이하 MTA)에 2개월 이상 장기지속형 후보 물질이 추가됐다고 29일 밝혔다. 이번 계약은 지난 22일 체결한 1개월 지속형 당뇨병치료제 상업적 개발을 위한 MTA에 2개월 내지 3개월마다 1회 투여 가능한 장기지속형 후보물질을 추가해 검증하는 내용이다. 회사 측은 해당 후보 물질이 최근 업그레이드된 스마트데포 기술을 추가 적용한 것으로 대동물에서 확인한 결과 지속 시간이 향상돼 인체에서 최장 3개월까지 약효 지속이 가능할 것으로 나타났다고 설명했다. 또 현재 당뇨 시장은 1주일 1회 투여 주사제가 선진국에서만 15조원으로 가장 큰 시장 규모를 차지하고 있는 만큼, 3개월 1회 투여가 가능하다면 주사 횟수가 연간 50회에서 연 4회로 10배 이상 줄어들기 때문에 환자 편의성과 치료 효과에서 기존 제품과 차별화가 극대화될 것으로 보인다고 밝혔다. 펩트론 관계자는 “장기지속형 치료제는 당뇨 시장 패러다임을 바꿀 수 있는 게임체인저가 될 것”이라며 “ 계약 상대방인 글로벌 대형제약사도 이에 대한 필요성과 기대감을 나타냈다”고 전했다. 펩트론은 후보물질 검증을 신속히 완료하고 1개월 이상 장기지속형 당뇨치료제 상업화 개발 파트너십을 확고히 한다는 방침이다. |
* 펩트론 "전립선암 치료제 '루프린' 생동 동등 제네릭 개발 성공" (2022.11.18)
http://m.yakup.com/news/index.html?mode=view&cat=&nid=275758
| 펩트론(대표이사 최호일)은 1개월 지속형 제네릭 의약품인 전립선암 치료제 ‘PT105’의 생물학적 동등성(BE) 시험 결과 동등성을 확보했다고 지난 17일 밝혔다. PT105의 오리지널 의약품인 다케다의 ‘루프린’은 1989년 출시 후 30년이 넘도록 세계 시장 점유율 1위를 기록하고 있는 대표적인 블록버스터 의약품이다. 현재 물질 및 제조 특허가 모두 만료됐으나 제조 공정 및 기술 재현이 까다로워 국내뿐만 아니라 미국, 유럽 등 선진국에서도 생물학적 동등성까지 재현한 제네릭은 아직 없는 상태이다. 펩트론은 자사의 기반 기술인 스마트데포 기술을 적용해 류프로렐린 성분의 오리지널 제품 ‘루프린’과 1개월 지속 방출 패턴까지 동등하도록 구현했다. 이는 국내 경쟁 제네릭 의약품 대비 생동성까지 확보한 제품이라는 점에서 그 의미가 크다. 펩트론 관계자는 “대조 의약품인 다케다의 '루프린' 대비 약물의 입자 크기 및 주사 바늘의 굵기까지 줄임으로써 품질과 투약 편의성을 혁신적으로 개선하였고, 향후 시행 예정인 식약처의 동등성 재평가 기준 또한 이미 충족한 상태로 제네릭 제품 내 상대적 경쟁우위를 바탕으로 빠르게 시장을 잠식해 나갈 것”이라고 말했다. 이어 “동등성 결과 확보 전에 이미 국내 대기업을 비롯한 유수의 제약사들과 판권에 대한 논의를 진행해 왔고, 계약은 가까운 시일 내 체결할 것”이라고 밝혔다. 업계에 따르면 2021년 국내 류프로렐린 3.75mg 시장은 약 600억 원으로 이중 오리지널 의약품은 약 150억 원, 제넥릭 의약품은 약 450억 원으로 추산되며, ‘PT105’는 약물동력학(PK) 동등성을 확보한 제넥릭 의약품이라는 강점을 바탕으로 최소 연간 100억 원 이상의 매출 발생이 기대된다. 펩트론은 ‘PT105’를 통한 안정적인 Cash-Cow 확보뿐만 아니라 높은 마진율에 따른 수익성 개선까지 도모할 수 있게 되었다. 최호일 펩트론 대표이사는 “PT105의 국내 시장 출시 후 해외 판권 계약 및 선진국 기준의 생동성 시험을 진행헤 약 2조 원 규모의 글로벌 류프로렐린 제제 시장에 진출할 것”이며 “올해 미국 FDA 3상 승인을 획득한 PT320과 함께 당사의 약효지속성 의약품 기술과 생산 능력이 글로벌 스탠더드에 부합하는 우수함과 상용화 능력을 갖추고 있음을 입증하는 성과”라고 밝혔다. 한편 펩트론은 글로벌 시장 점유 확대를 위한 3개월, 6개월 제형 개발을 이미 준비하고 있으며, 본격적인 양산체제를 갖추기 위해 바이넥스 바이오생산본부장 출신의 이병인 전무가 오송공장의 생산을 진두지휘할 예정이다. |
* 펩트론, 中 치루제약과 PAb001-ADC 기술검증 완료 (2022.03.28)
http://m.yakup.com/news/index.html?mode=view&cat=&nid=267606
| 펩트론(대표이사 최호일)이 중국 치루제약(Qilu Pharmaceutical)으로부터 자사의 표적항암 항체치료제 후보물질 PAb001-ADC의 기술이전(L/O)에 대한 기술 검증이 완료되어 잔여 계약금 입금이 확정됐다고 28일 밝혔다. 펩트론은 지난해 3월 치루제약과 기술이전 계약을 체결했으며, 그 규모는 5억 4,361만달러에 이른다. 이번에 자료 이전 기술료로 수령하는 잔여 계약금은 161만 8,000달러이며, 선급금 300만 달러는 이미 수령한 상태다. 펩트론은 자사의 ‘PAb001’을 활용해 MUC1 과발현에 의해 유발되는 암종에 대한 치료제 개발 및 기술협력을 진행해왔다. ‘PAb001-ADC’는 치루제약과 기술이전 계약을 체결했고, 유도만능줄기세포(iPSC) 기반 NK세포치료제 회사 테라베스트(THERABEST)와는 차세대 'CAR-NK' 면역항암 세포치료제를 공동 개발하고 있으며 향후 추가 기술이전도 계획하고 있다. 회사 관계자는 ‘’기술 검증을 위해 지난 1년간 100회 이상의 미팅을 하며 개발 및 생산의 격차를 줄여왔으며 생산된 항체물질은 기존 시제품으로 생산했던 물질 수준으로 생산이 완료되었다.”며 “ADC제작도 기존 파트너사의 수율(Yield), 균일성(DAR Distribution) 및 순도(Purity)를 뛰어넘는 수준으로 생산되어 이를 이용한 효능 및 비임상 실험을 진행했으며 약 25종이 넘는 기술 관련 검증이 마무리되었다.”고 밝혔다. 최호일 대표이사는 “1년 동안 평가를 진행하며 여러 난관이 있었으나, 많은 시험과 논의를 통해 극복되었다”며 “향후 IND 일정에 따라 추가 마일스톤을 수령하여 회사의 매출 증대에 크게 기여할 것은 물론, 완전관해를 특징으로 하는 PAb001-ADC를 신속히 임상개발하여 암으로 고통받는 환자들을 위한 치료제를 개발하겠다”고 앞으로의 포부를 밝혔다. 한편 'PAb001'은 펩타이드를 이용해 특정 표적의 항체를 유도할 수 있는 펩트론의 '펩젠' 기술이 적용된 1호 항체 신약으로 암세포 특이적인 세포 표면 당단백질인 '뮤신1(MUC1)'에 결합한다. |
* 펩트론 '황금낙하산' 조항 신설…적대적 M&A 대비 (2022.03.04)
http://www.press9.kr/news/articleView.html?idxno=50793
| 펩트론이 적대적 M&A에 대비해 경영진에게 거액의 퇴직금 지급을 명시하는 '황금낙하산' 조항을 도입한다. 4일 전자공시시스템에 따르면 펩트론은 오는 28일 열리는 제 25기 정기주주총회에서 ▲재무제표 승인의 건 ▲정관일부변경의 건 ▲이사 재선임 및 감사 선임 ▲이사 보수한도액 승인의 건 등을 안건으로 상정했다. 회사는 정관 변경 안건으로 적대적 인수합병에 의한 이사 선임 및 해임 요건을 강화하기 위해 '황금낙하산' 조항을 신설했다. '황금낙하산'이란 적대적 M&A로 인해 경영진이 비자발적으로 해임하게 될 경우를 대비해 거액의 퇴직위로금을 지급하도록 하는 제도다. 인수합병 비용을 높여 경영권을 방어하기 위한 목적이다. 펩트론은 정관 제40조(이사의 보수와 퇴직금) 항목에서 ▲"대표이사가 자진퇴임이나 기간만료에 의한 퇴임의 경우 이외에 적대적 기업인수 및 합병으로 인해 임기중 해임된 경우에는 임원 퇴직금 지급규정에 의한 금액 이외에 근속기간에 따른 제2항의 퇴직금누계액의 이십(20)배를 퇴직보상액으로 지급한다"는 내용을 신설했다. 적대적 인수합병에 의한 이사 선임 및 해임 요건도 강화했다. 펩트론은 정관 제33조(주주총회의 결의방법) 항목에서 ▲"적대적 인수합병으로 인해 신규로 이사를 선임하거나 이사회구성 이사 중 정당한 사유 없이 이사의 해임을 결의하는 경우에는 출석한 주주의 100분의 80이상의 수와 발행주식총수의 100분의 75 이상의 수로 해야 한다"는 내용을 신규 삽입했다. 펩트론의 오너인 최호일 대표이사의 지분율은 8.37%다. 최호일 대표와 특수관계인을 포함한 지분율은 9.46%에 불과해 경영권 방어에 취약한 상태다. 경영권 보호 수단으로 '황금낙하산' 제도를 채택한 것이다. 펩트론은 이밖에 ▲주식매수선택권 ▲신주의 동등배당 ▲사채발행에 관한 준용규정 ▲주주명부의 폐쇄 및 기준일 등 일부 정관에 대해서 간소화 및 변경하도록 하는 내용도 정관 변경 사항에 포함시켰다. |
* [펩트론] 독자적인 펩타이드 기반 플랫폼 기술을 보유한 바이오기업 (2022.03.03)
| ■ 기업개요 동사는 1997년 11월 설립되어 펩타이드 공학 기반 펩타이드의 합성기술 개발과 신물질 발굴하여 바이오의약품을 개발하고 있는 기업이다. 동사는 20년 이상 펩타이드 소재에 대한 합성, 연구개발 경험을 바탕으로 펩타이드 전자동화 합성 기술인 PeptrEX 기술, 약효지속성 제형의 설계와 제조가 가능한 SmartDeptTM 플랫폼 기술, 펩타이드(단백질 포함)를 이용한 새로운 항체를 발굴하는 PepGenTM 플랫폼 기술 등을 독자적으로 개발하여 보유하고 있다. 동사는 이러한 플랫폼 기술을 기반으로 펩타이드 제작 및 판매, 펩타이드 및 항체를 이용한 전립선암 치료제, 말단비대증 치료제, 당뇨병 치료제, 퇴행성 신경질환 치료제 등으로 구성된 파이프라인 개발, 히알우로니다아제를 주성분으로 하는 제품을 판매하는 의약품 도매업을 영위하고 있으며, 약효지속형 주사 제형 SmartDeptTM 플랫폼 기술 생산 설비를 이용한 위탁 개발 생산으로 사업을 확장하고 있다. ■ 약효지속형 약물방출 제형 의약품 및 파킨슨병 치료제 시장현황 동사는 장기지속형 주사제 제조 플랫폼 기술인 SmartDepotTM를 기반으로 펩타이드를 유효물질로 하는 치료제를 개발하고 있다. 약물방출 약물전달시스템(Drug Delivery System, DDS)은 약물이 포함된 고분자 Depot으로 생산된 제형을 생체 내에 주입하여 농도차에 의한 확산과 생분해성 고분자의 분해에 따른 약물의 방출을 통하여 약물이 체내에 지속적으로 전달되게 하는 약물전달시스템이다. ■ 독자적인 SmartDepotTM, PepGenTM 플랫폼 기술을 이용한 파이프라인 구축 SmartDepotTM 기술은 1주부터 6개월까지 정밀한 약물방출 제어와 재현성 및 생산성이 높은 미소구체 제형을 제조하기 위해 동사가 독자적으로 개발한 기술이다. 이 기술은 생분해성 고분자(Poly Lactic-co-Glycolic Acid, PLGA)를 약물방출 조절 물질로 사용하여 다양한 펩타이드 약물의 약효지속성 주사제 개발에 적용이 가능하다. SmartDepotTM 기술은 대량생산이 가능하며, 비독성용매인 초산(Acetic acid)을 이용하여 독성용매의 잔류 이슈가 적고 기존의 기술과 차별화된 고효율 방식의 제조기술로써 동사는 관련 원천기술들의 특허를 확보하고 있다. 최근 이를 적용하여 의약품 제조에 최적화된 GMP용 초음파 분무건조기를 오송에 위치한 GMP 생산시설에 구축하였다.  또한, 동사는 새로운 항체를 발굴하는 고유의 기술인 PepGenTM을 이용하여 발굴한 항체(PAb001)를 이용한 ADC(Antibody Drug Conjugate) 표적 항암제 PAb001-ADC를 개발하고 있다. PepGenTM 기술은 올리고뉴클레오타이드 및 항원결정기를 포함한 리포좀을 면역 자극 성분으로 사용하여 항체를 발굴하는 기술이다. 동사의 PAb001은 유방암, 대장암, 급성 골수성 백혈병 등 다양한 암 조직 및 암 줄기세포에서 과발현되는 단백질 뮤신1을 표적하는 항체이며, 동사의 PAb001은 암 세포에 고정되어 있는 뮤신1 domain에 결합함으로, 정확하게 암세포를 표적하여 치료효과를 보일 것으로 기대된다. 2021년 3월 동사는 표적항암제 PAb001-ADC 파이프라인을 중국의 Qilu Pharmaceutical에 기술이전 하였다. Qilu Pharmaceutical은 항암제 분야에서 기업가치 9위의 글로벌 제약사로 자체적인 GMP 생산시설도 구축하고 있어 빠른 임상 진입이 기대된다. ■ 파이프라인 기술이전 및 SmartDepotTM 기반 위탁 개발 생산 수주를 통한 기술 고도화 동사는 독자적인 약효지속형 약물방출 제형 제조 기술인 SmartDepotTM을 이용한 다양한 치료제를 개발하고 있으며, 대웅제약과 공동개발하여 약효지속형 약물방출 제형인 전립선암 치료제 루피어데포주를 기술상용화한 경험을 가지고 있다. 동사는 이러한 제형 제조 기술 및 연구개발, 기술상용화 경험을 기반으로 파킨슨병 치료제 PT320와 전립선암, 자궁내막증, 성조숙증 치료제인 PT105(Lupron depot 제네릭)를 개발하여 기술상용화를 진행하고 있다. 또한, 새로운 항체 발굴 기술인 PepGenTM을 구축하여 표적항암제인 PAb001을 개발하고 있다. 파킨슨병 치료제인 PT320은 국내 임상 2상을 진행하고 있으며, 미국 하버드에서 알츠하이머에 대한 효능평가도 진행하고 있다. Lupron Depot 제네릭인 PT105는 연내 생동 시험을 완료할 예정이며 2023년 출시를 목표로 개발을 진행하고 있다. 2021년 3월 동사는 표적항암제 PAb001-ADC 파이프라인을 중국의 Qilu Pharmaceutical에 6,110억 원 규모의 기술이전을 하는 등(계약금 33.4억 원) 독자적인 기술기반 치료제 파이프라인의 개발을 진행하고 있다. 동사는 자체적인 GMP 생산시설에 SmartDepotTM 기술을 구현하는 설비를 구축하여 약물방출 제형을 생산할 수 있는 생산기반을 갖추고 있으며, 2021년 9월 호주의 제약사 인벡스와 특발성 두개 내 고혈압(Idiopathic intracranial hypertension, IIH)치료제 '프리세딘'에 대한 위탁 개발 생산계약을 체결하여 약물방출 제형으로 생산하여 공급하기로 하였다. 인벡스는 매일 투약하는 단기주사 제형으로 미국과 유럽에서 임상 2상을 완료하였으며, 동사의 약효방출 기술을 적용하여 주 1회 주사 제형으로 임상 3상 및 상용화를 계획하고 있다. 동사는 임상 3상 및 제품의 완제의약품(DP) 생산과 국내 독점 사업화 권리를 취득하였으며, 2021년 11월 임상용 의약품 공급 주문을 받아 위탁 개발 생산계약을 수행하고 있다. |
* 펩트론 기업 홍보영상(국문, 2020년)
https://www.youtube.com/watch?v=bFqXiEkLCKE
* [펩트론] 알테오젠의 향기가 난다 - 한양증권 (2020.06.22)
http://hkconsensus.hankyung.com/apps.analysis/analysis.downpdf?report_idx=563955
| 플랫폼 기술이전은 최근 바이오의 트렌드 현재 펩트론의 주가는 다른 플랫폼 베이스의 바이오 업체 대비 현저한 저평가 구간으로 보인다. 그동안 펩트론이 저평가 받았던 이유는 하나다. LO이슈가 만들어진 이후 실질적인 LO가 한번도 나오지 않았으며 이로 인해 시장의 신뢰를 잃었다. 이는 반대로 말하면 기대감이 없는 상황이기 때문에 다수의 LO 협의중인 파트너들과 함께 첫번째의 계약만 성사된다면 주가에 상당히 큰 모멘텀으로 작용할 수 있음을 의미한다. 동사의 메인 파이프라인은 표적항암 항체신약 Pab001과 뇌질환 타겟 펩타이드 의약품 PT320이 있다. PT320의 경우 기존 당뇨 치료제였던 exenatide를 NIH의 용도변경 특허에 대한 전용실시권을 확보해 파킨슨과 LID 치료제로 개발중인 파이프라인이다. 특히 NIH같은 미국 국가기관에서 펩트론 같은 소형 바이오텍과 계약을 체결했단 부분에서 파이프라인에 대한 가능성을 충분히 엿볼 수 있다. 기존 exenatide의 경우 뇌질환에 대한 일정 효과에도 불구 효율성이 떨어졌던 이유는 BBB(뇌혈류장벽)투과율이 0.8~1.0% 수준의 낮은 레벨에 머물렀기 때문이다. 허나 펩트론의 Smartdepot 기술력과 exenatide 결합시 BBB가 2%이상 올라가는 수치를 나타냈다. BBB는 약물이나 바이러스 같은 외부 침입으로부터 뇌를 보호하는 기능을 가지고 있어 뇌벽투과율이 올라가지 못한다면 약효는 떨어질 수 밖에 없다. 그렇기에 펩트론의 플랫폼이 더 가치를 조명받을 것으로 판단한다. Pab001은 뮤신1을 타겟으로 하는 표적항암 항체 신약이다. 뮤신의 경우 대부분의 암종에서 90% 내외의 발현율을 나타내기 때문에 타겟 항원으로 잡을 경우 높은 확률로 암세포를 타겟할 수 있다. 그러나 암세포가 뮤신1을 잘라내는 특성을 가지고 있어 표적항원으로 삼기가 쉽지 않았다. 동사의 Pab001은 세포와 결합되어있는 Domain을 타겟함으로써 다양한 암종으로 적응증이 확대 될 수 있을 것으로 보인다. Pab001의 확장성에 주목한다 세포표면 당단백질인 MUC1을 타겟하는 항체 플랫폼 Pab001은 비단 TNBC에 대한 LO 뿐만 아니라 다양한 암종으로 확장성이 존재한다. 뮤신1의 경우 미국 국립암센터에서 발표한 75개 암 표적물질 중 2위에 랭크됐으며 이는 뮤신1을 정확히 타겟할 수 있을 시 높은 확률로 암세포 사멸이 가능함을 의미한다. MUC1의 경우 기존 shedding domain을 타겟하게 되면 잘려나가게 되어 정확한 타게팅이 불가능 했다. 허나 동사의 Pab001은 세포와 결합된 OT-MUC1을 타게팅 함으로써 암세포가 뮤신을 잘라내더라도 정확한 목표 타게팅이 가능하다. 특히 이는 ADC와 결합할 경우에 더 큰 시너지를 낼 수 있을것으로 보이는데, 약물 독성 때문에 정상세포에 대한 위험성으로 사용하지 못했던 약물을 동사의 항체를 통해서 전달할 수 있게 되면 암세포에 보다 더 강한 약물을 전달할 수 있다는 의미다. 동사는 Pab001에 대해 유럽,미국 글로벌 파마 7곳과 협상을 진행하고 있으며 미국계 바이오텍 한군데와 올해 3월 MTA가 만료되어 보다 더 긴밀한 내용이 협의될 것으로 예상된다. Pab001의 경우 한 곳과의 독점적 계약보다는 현재 바이오의 트렌드인 다수의 제약사와의 LO가 유리할 것으로 보이는데, 오늘부터 시작되는 AACR에서 동물임상 데이터를 발표하고 다국적 제약사들과 본격적인 LO가 보다 빠르게 가시화 될 것으로 보인다.  뇌질환 치료제 PT320의 가능성 동사의 PT320 파이프라인은 파킨슨과 LID 적응증으로 개발되고 있는 상태다. 파킨슨은 주로 노년층에서 발생하는 질환으로 연령이 증가할수록 걸릴 위험이 점점 증가하며 60세 이상의 노령층에서 약1%, 65세 이상에서는 약 2% 정도가 파킨슨을 앓고 있으며 의료적 미충족 수요가 상당히 크다. 파킨슨은 중뇌 흑질에서 도파민 분비 신경 세포의 사멸에 의해 나타나는 퇴행성 신경질환으로, 주요증상으로는 느린운동, 떨림, 근육강직 등이 있다. 현재 파킨슨의 표준 치료제는 상딜된 도파민을 대체하는 Levodopa 계열 약물이 전부이며 전세계 M/S의 90%를 차지하고 있는데 이는 원척적인 치료법이 아닌 일시적인 진통제나 다를게 없는 약물이다. 특히 레보도파 계열 약물은 LID(레보도파유발이상운동증후군) 같은 부작용도 만들기 때문에 근본적인 파킨슨 치료제는 없는 것이 현실이다. 이에 동사는 기존 당뇨약으로 사용중인던 GLP-1 계열의 약물인 exenatide에 동사의 smartdepot 플랫폼을 더해 파킨슨과 LID 치료제로 개발 중이다. 올해 3월 파킨슨 환자 100명 대상 48주투여 12주 wash out / 레보도파 + PT320 과 대조군 레보도파 프로토콜로 임상에 진입했다. 특히 뇌질환에 대해 특정 바이오마커가 정해지지 않아 신뢰성이 떨어지는 부분을 보완하기 위해 임상 결과에 대해 미 국립보건원 바이오마커 분석 책임자를 선임해 임상의 신뢰도를 높였다. 일정부분 임상의 결과가 긍정적일 것으로 추론할 수 있는 근거는 PT320의 해외 자문위원단인 Tom Foltynie 교수의 임상 결과이다. 동사가 진행하는 임상 프로토콜과 똑 같은 프로토콜로 2017년 논문에 게재 되었던 임상 결과를 참조하면 기억력과 운동능력에서 확연한 차이를 나타낸다. 이러한 임상 결과를 근거로 판단하면, 기존 exenatide에 BBB투과율을 개선해 성능이 개선된 PT320은 기존 톰 교수의 임상결과보다 더 드라마틱한 결과를 나타낼 수 있을것으로 판단되는데, 동사는 빠르게 21년까지 임상을 마무리 한 후 임상 evidence를 종합해 LO에 나설 것으로 예상된다. |
* [펩트론] 서방형 약물 방출 기술 기반 신약 개발 기대 (2019.10.17)
| 동사의 의약품은 약효지속화 기술이 적용된 약효지속성 의약품에 속한다. 약효지속성 의약품이란 반감기가 짧은 활성 물질의 체내 잔류 시간을 증가시키기 위해 다양한 물리화학적 기술을 이용하여 서방형(SR) 또는 지속형(Long-acting) 형태로 제조하여 최적의 효력을 발휘하도록 하는 일련의 의약품을 총칭한다. 약효지속화 기술은 약물의 부가가치를 높이고 특허 만료를 앞둔 제품의 수명을 연장하는 데 효과적으로 이용할 수 있어, 의약품 개발 선진국을 중심으로 기술개발이 활발하게 이뤄지고 있다. 글로벌 제약사들은 독성이 낮고 약효가 우수한 장점을 지닌 각종 호르몬 유래의 펩타이드 제제들을 개발하고 있다. 그러나 이러한 펩타이드는 경구 이용률이 낮아 주로 주사제로 개발되고 있으며, 생체 내 반감기가 짧아 자주 주사해야 하는 단점이 있다. 동사의 SmartDepotTM 기술은 미립구가 펩타이드 약물을 서서히 방출시키기 때문에 기존 펩타이드 제품보다 상대적으로 투약 편의성(반감기 증가)을 높인 펩타이드 의약품을 제조할 수 있다. 이러한 장점으로 인해 다양한 제약사에서 동사의 기술을 활용하고자 하는 요구가 존재하였으나 대규모 생산시설 부재로 의약품 개발에 어려움이 많았다. 그러나, SmartDepotTM 기술을 구현할 수 있는 대규모 생산시설을 확보함에 따라 그동안 관심을 보인 여러 글로벌 제약사와 펩트론의 본격적인 공동연구개발이 시작될 것으로 기대된다. 동사는 SmartDepotTM 기술을 대웅제약의 전립선암 치료제에 기술이전하여 치료제 시판에 성공하였다. 대웅제약의 1개월 지속형 전립선압 치료제 루피어데포주(Luphere Depot, SR-Leuprolide)는 다케다의 오리지널 의약품인 루프론데포(Lupron Depot)의 제네릭 의약품으로 펩트론의 기술이 구현된 최초의 제품이다. 동사는 대웅제약에 기술을 이전하여 2018년 8월까지 순매출액의 5%를 로열티로 수령하였다[표 4]. 한편, 대웅제약과의 계약이 2018년 8월 종료됨에 따라 동사는 새로운 파트너사를 물색하는 한편 자체적으로 의약품을 개발하는 방법도 강구하고 있는 것으로 파악되었다. 펩트론은 독자 개발한 펩타이드 자동합성기(PeptrEX)를 이용하여 1997년부터 약 50,000여 종의 펩타이드를 자체 합성하여 생산 중인 펩타이드 합성 전문기업이자 서방형 약물 방출 조절 시스템을 개발하여 펩타이드 의약품 등을 개발하고 있는 의약품 개발기업이다. 본 보고서에서는 동사 사업영역 중 고부가가치 산업이자, 동사의 중점개발 분야인 의약품 개발 분야에 집중하여 작성하였다. 동사는 펩타이드 의약품과 항암 항체 의약품을 주요 파이프라인으로 개발하고 있어 이과 관련된 기술을 분석하였다. 동사 고유의 기반 기술인 SmartDepotTM 기술은 ‘초음파 분무건조(Ultrasonic Spray-Drying)에 의한 약효지속성 마이크로스피어(Microsphere, 미립구) 제형 제조기술’이며, 기존 기술과는 차별화된 미립구 제조 기술이다[그림 6]. 초음파 분무건조 미립구 제조 방식은 기존의 에멀션(Emulsion) 방식과 비교 시 원료의약품(Active pharmaceutical ingredient, API)의 용매로 독성 유기용매를 사용하지 않아 독성이 적으며, 초음파 강도 조절을 통해 정밀한 입자 크기 제어가 가능하고, 제조 재현성이 우수한 장점이 있다. 또한, 기존 방식보다 더 작고 균일한 미립구여서 주사제로 이용 시 분산성과 현탁성이 우수하다. 동사는 SmartDepotTM 기술로 생분해성 고분자 농도 조절 및 미립구 크기 조절을 통해 1주부터 6개월까지 정밀한 약물 방출을 제어할 수 있으며 재현성 및 생산성이 우수하다. 동사는 이러한 제형 기술을 바탕으로 미립구 제형을 제조하고 있으며, 당뇨 및 비만 치료제로 널리 이용되고 있는 GLP-1 agonist(작용제)를 이용한 약효지속성 펩타이드 의약품을 개발하고 있다. GLP-1은 장에서 분비되는 호르몬의 일종으로 음식물을 섭취하면 장에서 GLP-1이 분비되고 인슐린 분비를 촉진하는 역할을 수행하는 것으로 알려져 있다. GLP-1의 분비가 감소하면 인슐린 분비가 함께 감소하면서 혈당을 상승시키게 되는데 이를 이용한 당뇨병 치료제가 시판 중이다. GLP-1은 장에서 분비되는 호르몬의 일종으로 음식물을 섭취하면 장에서 GLP-1이 분비되고 인슐린 분비를 촉진하는 역할을 수행하는 것으로 알려져 있다. GLP-1의 분비가 감소하면 인슐린 분비가 함께 감소하면서 혈당을 상승시키게 되는데 이를 이용한 당뇨병 치료제가 시판 중이다. 대표적인 GLP-1 당뇨 치료제는 2005년 Astrazeneca에서 개발한 Exenatide가 최초로 시판 허가를 받으면서 시장이 형성되기 시작하였고, 이후 1일 제형 제품(Liraglutide)이 개발되면서 시장이 성장하기 시작하여 2014년 Eli Lilly에서 일주일 제형 제품인 Trulicity(Dulaglutide)를 시판하면서 시장을 지배하고 있다. 동사 역시 SmartDepotTM 기술을 이용하여 약효지속성 GLP-1(SR-Exenatide) 당뇨 치료제를 개발하여, 국내 임상 2상을 완료하고 3상을 준비중이었으나 이미 경쟁이 치열한 시장이 되어버린바 과감히 개발 우선순위를 조정하여 미국 NIH로부터 전용실시권을 확보한 GLP-1 뇌질환 치료제(PT320) 개발에 집중하고 있다. 과거 여러 연구에 따르면 인슐린 신호전달 경로 장애로 파킨슨병 등 퇴행성 뇌질환이 발생할 수 있다는 당뇨병과 퇴행성 뇌질환의 연관성을 제시한 결과가 보고된 바 있다. 또한, 미국 NIH 연구팀에서는 중추신경계에 존재하는 GLP-1 수용체가 자극을 받으면 신경세포 손상을 방어하여 퇴행성 뇌질환 치료를 촉진할 수 있다고 보고하였다[그림 7]. 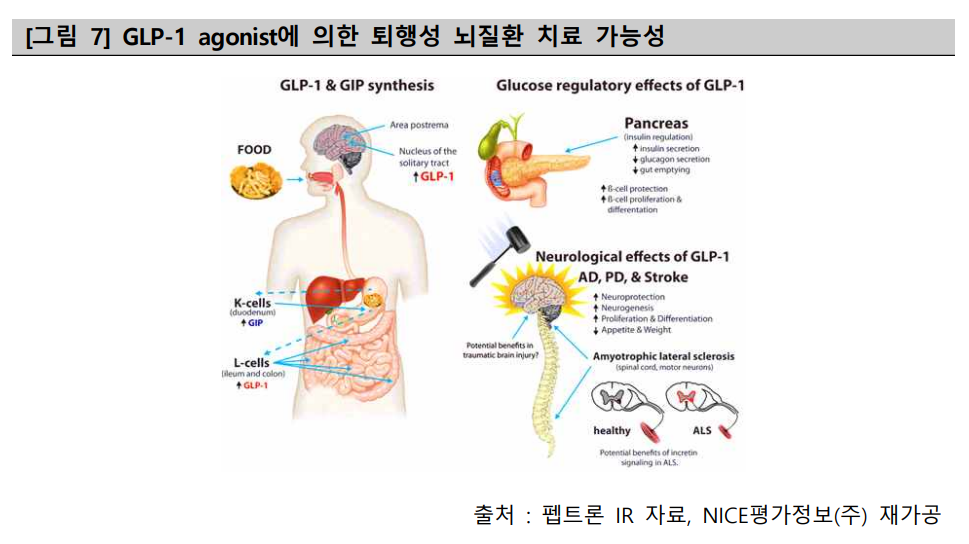 미국 NIH 연구팀은 GLP-1의 퇴행성 뇌질환 치료제 용도 특허를 등록했으며 동사는 2014년 해당 특허의 전세계 독점 전용실시권을 확보하여 퇴행성 뇌질환 공동연구 및 SmartDepotTM 기술이 적용된 파킨슨병 치료제를 개발하고 있다. 파킨슨병은 도파민 뉴런이 파괴되어 도파민이 부족하게 되어 발생하는 뇌질환으로 치료요법으로 도파민을 보충해주는 레보도파(Levodopa)라는 도파민 전구체를 투여하는 방법이 있다. 레보도파는 신경세포의 사멸을 방어하거나 신경세포의 생성을 유도할 수 있는 약물이 아닌 단순히 체내에 부족한 도파민을 보충해주는 역할을 할 뿐이다. 레보도파를 투여하더라도 여전히 뉴런의 사멸이 진행되기에 본질적으로는 파킨슨병을 치료한다고 보기 어렵다. 동사는 파킨슨병 Rat 모델에서 SR-Exenatide를 투여한 치료군과 대조군에서 도파민 활성화 정도를 측정하는 티로신 수산화 효소 면역 염색을 한 결과 치료군에서 도파민 활성 반응이 현저히 증가하였음을 확인하였다. 또한, 신경학적 행동검사에서도 대조군 대비 치료 효과가 있음을 확인하였다[그림 8]. 이러한 결과는 GLP-1이 기존 파킨슨병 치료제인 레보도파와는 다르게 신경 손상 보호 효능이 있어 파킨슨병 치료제로 활용될 수 있음을 보여주고 있다.  또한, SR-Exenatide(SR-Ex-4)를 일반 Exenatide(Ex-4)와 비교할 시 뇌척수액(CSF)에서 SR-Exenatide의 농도가 더 높게 나타났다[그림 9, G1: 0.4mg/kg, G2: 1.0mg/kg, G3: 2.0mg/kg]. SR-Exnenatide의 뇌장벽(BBB) 투과율이 Exenatide보다 높은 것으로 확인되어, 실제 뇌에 작용하는 GLP-1의 농도가 높아 파킨슨병의 치료 효능이 더 좋을 수 있을 것으로 전망하고 있다.  |
* [펩트론] 선택과 집중 신규 파이프라인까지 달라진 펩트론의 R&D - 하나증권 (2019.06.12)
http://hkconsensus.hankyung.com/apps.analysis/analysis.downpdf?report_idx=528205
| 펩트론의 플랫폼 기술인 SmartDepot 기술은 기존의 에멀전 방식의 한계를 극복한 혁신적인 서방형, 즉 지속형 기술이다. 기존 에멀전 방식의 단점인 미립구의 균질성 및 크기, 그리고 공정 중 발생하는 유기용매와 그로인한 가열공정 등 많은 단점들을 극복한 기술로 작년 완공한 오송 1공장이 올해 2월 KGMP 인증을 획득하면서 펩트론은 본격적으로 SmartDepot 기술을 완성할 수 있게 되었다. 펩트론은 이와 같은 서방형 기술인 SmartDepot 플랫폼 기술 이외에도 항체신약을 개발할 수 있는 펩젠(PepGEN) 플랫폼 기술을 보유하고 있다. 펩트론은 두 개의 플랫폼 기술을 활용한 자체신약 개발은 물론 향후 SmartDepot 기술을 적용, 지속형 물질을 개발하고자 하는 글로벌 제약사들과의 파트너링도 본격적으로 추진할 예정이다. 펩트론은 SmartDepot 기술이 적용된 Exenatide(GLP1)의 지속형 물질인 PT320과 PepGEN 기술을 통해 발굴된 MUC1 타겟 항체신약인 PAb001 자체 파이프라인을 보유하고 있다. 펩트론이 개발한 PT302은 Exenatide의 1주 지속형 제제로 체내에서 약물을 일정하게 유지할 경우 뇌벽(BBB) 통과가 더 용이하다는 동물실험 결과를 획득, 향후 임상 시 기존 1일 제형인 Exenatide 대비 파킨슨 병 치료효과가 더 좋을 것이라는 추론이 가능해졌다. 펩트론은 5월 20~23일 개최된 2019 Tides(신경학회)에서 이러한 동물실험 데이터를 발표하였다. 펩트론이 펩젠(PepGEN) 기술을 통해 개발한 항체신약 PAb001은 Mucin1으로 알려진 MUC1을 타겟을 개발된 항체의약품이다. 세포표면에 발현된 당단백질(Glyciprotein)인 뮤신1(MUC1)은 유방암, 췌장암, 난소암, 대장암, 급성 골수성백혈병 등 다양한 암세포에서 높게 발현되는 특성을 보유한다. 암세포에 과다 발현되어 있는 뮤신1은 암세포 전이 시 당이 붙어있는 윗 부위가 잘려져 나가는 특성을 보이고 있다. 타사에서 개발한 MUC1 타겟 항체들이 잘려나가는 윗 부위를 타겟으로 개발된 반면 펩트론은 뮤신1이 세포와 결합되어 남아있는 부위를 타겟함으로서 전이 이후의 암세포에서도 치료효과를 기대할 수 있다. HER2가 과발현되어 있는 종양 동물모델에서 PAb001은 기존 HER2를 타겟으로 개발된 케사일라(Kadcyla)와 비슷한 종양억제 효과를 보이고 있다. 그러나 케사일라의 경우 HER2가 발현되지 않은 삼중음성유방암 관련 동물모델에서는 종양이 감소되지 않는 반면 PAb001은 크게 억제되어 있음을 확인, 향후 난치암 중 하나로 꼽히는 삼중음성유방암 치료제로서의 가능성을 확인하였다. 2) 지속형 Exenatide, PT320 당뇨 및 비만 치료제로 널리 이용되고 있는 GLP1 치료제 시장은 이미 지속형 제제로 일라이릴리사의 트룰리시티(Trulicity)가 2018년 기준 $3.2B 달러의 매출을 기록하며 시장을 지배하고 있고, 2017년 12월 승인받은 노보노디스크사의 오젬픽(Ozempic)이 Best in class의 자리를 노리며 맹 추격중으로 이 시장은 이제 경쟁이 치열한 시장이 되어버렸다. 이로 인해 펩트론은 PT320(지속형 GLP1)에 대해 당뇨 비만 적응증 관련 임상은 과감히 뒤로 미루고 전용실시권을 확보한 뇌질환 관련 임상을 집중적으로 추진할 예정이다. 이미 많은 연구들은 통해 GLP1이 뇌신경 보호효과가 있음을 확인되었고, 특히 영국의 런던대학교 폴티니(Dr. Tom Foltynie) 교수가 수행한 연구자 임상 결과를 통해 GLP1이 파킨슨 환자의 인지 및 운동능력이 개선되었음을 확인하였다. (출처: Lancet, 2017.10)  |
* 혁신과 가능성의 발란스 - 키움증권 (2019.05.27)
| GLP-1 파킨슨 치료제 임상 성공 가능성 높아 파킨슨병은 도파민 부족으로 일어나는 현상이기 때문에 주된 치료 요법으로 도파민을 보충해주는 것을 사용한다. 도파민이 뇌혈관장벽(BBB)를 통과하지 못하기 때문에 L-dopa를 사용해 BBB 통과해 뇌에 도달해 뉴런이 도파민으로 전환시킨다. 다만, 레보도파는 사용 이후 6년 이상 경과시 약 75%의 환자들은 이상운동증 등의 다른 합병증이 생기기 때문에 환자의 연령 등을 고려해야한다. 도파민효능제는 레보도파 대비 이상운동증을 덜 유발하지만, 고령 환자의 경우 혼동이나 환각을 잘 일으킬 수 있다는 부작용이 있다. 이렇듯 파킨슨병은 미충족 의료 수요가 높은 질병이다. 동사는 미국 국립보건원(NIH)로부터 GLP-1제제 퇴행성 뇌질환 용도특허 전용실시권을 ‘14년 확보하여 현재 국내 2상 중이다. GLP-1 제제는 여러 논문을 통해 파킨슨병에 치료 효과를 나타낸 바 있다. University College London 연구팀이 Bydureon으로 62명 중등도 파킨슨 환자 대상으로 1년간 투약한 결과 운동 증상 개선을 보였으며, 복용 중단한 후 12주가 지난 후에도 지속되었다. Cedars-Sinai Medical Center에서도 노보노 디스크의 GLP-1 제제 빅토자를 가지고 57명 대상 파킨슨 2상 연구 중에 있다. 과거 연구들에 의하면 인슐린 신호 전달 경로 장애로 파킨슨병이 생길 수 있어 당뇨병과 신경 퇴행성 질환과 연관성을 제시한 바 있다. GLP-1 수용체는 중추 신경계에 존재하며 자극을 받으면 세포 생존과 신경 보호를 촉진할 수 있는 역할을 한다. 다만, 짧은 반감기와 BBB 통과 등이 치료의 제약으로 남아있는데, 동사의 PT302는 장기 방출제제다. 파킨슨병 Rat 모델에서 PT302 단회 투여로 20일 넘게 쥐의 혈장에서 높은 수준의 exendin-4가 유지되었다. PT302 치료 후 뇌 손상이 있는 쥐의 뇌에 도파민 활성화 뉴런을 측정하는 티로신 수산화 효소 면역반응(TH-IR)이 현저히 증가하였다. 영국 런던대 Dr. Foltynie 교수가 파킨슨 환자 68명 대상으로 GLP-1 약물의 파킨슨병 치료 효과에 대해 연구한 결과 투약 48주까지 대조군(레보도파) 대비 -4.3포인트의 격차를 나타냈다. PT302는 지속형제제로 뇌벽을 더 잘 통과하여 뇌 안에 지속적으로 약효가 남아있을 것으로 추측되기 때문에 2상에서 긍정적인 효능을 나타내어 성공 가능성이 높을 것으로 기대하고 있다.  울산대 의과대학 서울중앙병원 신경과학교실의 ‘파킨슨병 치료’에 관한 자료에 의하면, 파킨슨병치료의 일반 원칙은 신경보호작용이 있는 약이 있다면 우선적으로 투여하는 것으로 2상에서 PT302의 신경보호작용 또한 확인된다면 향후 상용화 성공 가능성도 높다 할 수 있겠다. GLP-1제제의 퇴행성 뇌질환 전세계 독점권의 1차 특허는 ‘25년 만료이며, 최근 치료용도의 특허를 추가로 확보했다. 또한, 미국은 신규 적응증에 대해 3년 독점기간을 부여하고, 특허 존속기간이 얼마남지 않은 의약품 대상으로 5년간 특허기간 연장해주는 제도도 운영하고 있다. PT302는 ‘19년 하반기 첫 환자 투약을 시작으로 약 1년간의 임상을 걸쳐 ‘20년 하반기 국내 2상 완료 후 기술수출을 목표로 하고 있다. 파킨슨병치료제 외에 레보도파 유발 이상운동증(LID, Levodopa Induces Dyskinesia) 적응증과 외상성 뇌손상(TBI) 적응증으로도 확장하여 전임상 개발 중에 있다. |
* [펩트론] 대세는 지속형 기술 - 하나증권 (2019.02.11)
http://hkconsensus.hankyung.com/apps.analysis/analysis.downpdf?report_idx=512433
| 사노피 dual agonist 당뇨치료제 개발 중단 선언 사노피는 2월 8일 4분기 실적발표 컨퍼런스 콜에서 당뇨/비만 치료 후보물질인 GLP1/GCG(SAR425899), GLP1/GIP (SAR438335) dual agonist의 개발을 중단한다고 발표하였다. 더불어 사노피의 R&D 집중 질환 분야도 항암제, 희귀질환, 뇌신경질환, 면역조절제, 희귀혈액질환, 백신으로 언급하면서 그 동안 사노피의 주 타겟질환인 당뇨 분야가 제외되었다. 선택과 집중을 통한 투자 효율화 제고를 위한 목적으로 그 동안 사노피의 당뇨/비만 펩타이드 치료제와의 기술협력을 기대했던 펩트론 입장에서는 부정적인 뉴스로 인식될 수 있다. 1일 제형부터 임상을 실시했던 사노피가 틀렸다. 2018년 JP Morgan Conference에서 사노피가 발표했던 GLP1/GCG dual agonist의 임상 2상 결과는 매우 고무적이었다. 기존 GLP1 single agonist인 Liraglutide(Saxenda) 대비 체중 감소효과 면에서 월등한 효능을 보여주면서 시장의 기대를 한 몸에 받았으나, 4월 위장관 부작용이 나타나면서 사노피는 용량 재결정을 위한 임상 1상을 다시 시작했고, 관련해서 펩트론의 주가는 곤두박질 쳤다. 그러나 최근 당뇨/비만과 관련한 펩타이드 제제를 개발하고 있는 다른 경쟁사들을 보면, 1일 제형으로 우선 효능을 확인하고 지속형을 개발하기 보다는 바로 1주 제형으로 임상을 시작하고 있다. 대표적인 사례가 한미약품의 지속형 dual agonist인 LAPS-GLP1/GCG를 개발하고 있는 얀센과 2018년 10월 EASD(유럽 당뇨병학회)에서 지속형 GIP/GLP1의 임상 2상 결과를 발표한 일라이릴리가 있다. 당뇨/비만과 관련 dual agonist로 임상을 먼저 시작한 회사는 사노피였지만, 이미 기술의 대세는 지속형부터 임상을 시작하는 추세로 빠르게 전환되고 있었다. 오송 1공장 완공으로 날개를 단 펩트론 2018년 4월 준공된 펩트론의 오송 1공장은 펩트론의 SmartDepot 기술을 구현할 수 있는 생산 시설이다. 2월 중 KGMP 승인을 획득하게 되면, 드디어 펩트론의 플랫폼 기술을 적용한 임상 시료들이 대량으로 생산 가능하게 될 것으로 기대된다. 사노피는 컨퍼런스 콜에서 당뇨 관련 치료제 개발을 중단한 것은 아니라고 언급하였다. 오히려 지속형 기술 도입을 통한 차세대 물질 개발을 추진할 것으로 밝혔다. 시대에 뒤떨어진 1일 제형은 R&D 투자 효율화 제고 목적으로 과감히 중단하지만, 기술적 대세를 따라 지속형 개발은 오히 려 확대할 것으로 기대된다. 사노피의 일보전진을 위한 일보 후퇴 전략은 지속형 기술을 보유한 펩트론과 같은 회사들에게는 호재인 셈이다. 펩트론의 플랫폼 기술인 SmartDepot 기술은 기존의 에멀전 방식의 한계를 극복한 혁신적인 생산공정 그 자체라고 볼 수 있다. 즉 SmartDepot 기술은 그 기술을 구현할 수 있는 공장이 부재하다면, 결코 완성할 수 없는 기술이다. 이러한 이유로 펩트론은 상장 공모자금과 2016년 380억원 유상증자를 통해 공장 건립비를 확보 오송에 SR 1공장을 2018년 4월 준공하였다. 총 188억원을 투입한 건물은 대지 1만㎡, 건축연면적 4,700㎡, 지상 2층 규모로 GMP 기준에 적합하게 시공되었다. 펩트론의 오송 SR 1공장은 올해 2월 KGMP 인증 획득 이후 본격적인 임상시험용 시료를 생산할 예정이다. 펩트론은 향후 해외 임상 3상 및 상업용 생산을 위한 cGMP 기준에 부합할 오송 SR 2공장 건립도 수립할 예정이다. 생분해성 고분자를 이용 미립구 방식의 sustained release 지속형 방식은 가장 손쉽게 펩타이드를 지속형 물질로 개발할 수 있는 방식이다. 생체 내에서 지속형 특징을 보유한 각종 단백질(예를들어 Fc 등과 같은 단백질)을 접목하는 방식은 유전자 단계부터 변형시켜야 하고, 지속형 단백질을 접합하면서 원래 펩타이드의 구조가 변형된다는 점에서 효능 및 안전성이 기존의 펩타이드와 동일하다고 볼 수 없다. 생산에 있어서도 만약 동물세포 배양을 이용한 방식이라면, 생산성이 높은 세포주를 선별해야 하는 작업부터 시작해야 하기 때문에 개발 기간이 오래 소요될 수 있는 단점이 있다. 그러나 미립구 방식의 sustained release 방식은 기존의 펩타이드와 생분해성 고분자를 물리적으로 혼합해서 크기가 큰 미립구를 제작, 이 미립구가 체내에서 서서히 펩타이드를 방출시키기 때문에 기존 펩타이드 고유의 형태를 그대로 유지할 수 있다. 당연히 유전자 단계부터의 조작이 필요하지 않기 때문에 개발기간도 상대적으로 짧으며, 세포배양 생산방식이 아니기 때문에 생산 단가 측면에서도 경쟁 우위에 있다고 볼 수 있다. 아래 표 2에서 확인할 수 있듯이, 글로벌 제약사들은 당뇨 비만 치료제를 타겟으로 각종 호르몬 유래의 펩타이드 제제들을 개발하고 있다. 그러나 호르몬의 특성 상 반감기가 짧기 때문에 지속형 기술들의 접목이 시도되고 있다. 펩트론의 SmartDepot 기술은 기존 에멀전 방식 대비 적용 가능한 펩타이드 크기도 더 크고, 상업화 시 최대 난관이었던 주사바늘 크기도 작게 개발 가능하다는 점에서 기존 기술 대비 우위성을 확인할 수 있다. 이와 같은 sustained release 방식에 대한 글로벌 제약사들의 니즈가 높음에도 불구하고 펩트론의 한계는 그들의 기술을 구현할 수 있는 생산시설이 부재했다는 점이었다. 펩트론의 플랫폼 기술인 SmartDepot 기술을 구현할 수 있는 오송 SR1 공장이 완공된 현재 글로벌 제약사들과 펩트론의 본격적인 collaboration이 시작될 것으로 기대된다. |
* [펩트론] 펩트론 플랫폼 기술의 완성은 공장 - 하나증권 (2018.09.03)
http://hkconsensus.hankyung.com/apps.analysis/analysis.downpdf?report_idx=491944
펩트론의 플랫폼 기술의 컨셉은 Sustained release, 즉 서방형 기술로 생분해성 고분자(예를들면 PLGA)를 캐리어로 이용하여 미립구(microsphere) 형태로 제조, 약물방출을 조절하는 기술이다. 약물의 구조변형 없이 지속 방출이 가능하다는 점에서 약물의 크기를 늘리기 위해 PEG와 같은 고분자를 붙이거나, 항체의 Fc를 붙여서 생체 내 지속시간을 증가시키는 일반적인 Long acting 기술과는 다르다. Sustained release 서방형 기술의 가장 고전적인 생산방법은 에멀전(emulsion) 타입으로 에멀전 방식으로 미립구를 만들어 서방형 제제 기술을 보유한 대표적인 기업으로는 타케다(Takeda)와 알커머스(Alkermers)사가 있다. 타케다사의 SR 기술이 접목되어 미 FDA로부터 승인받은 루프론데포(Lupron Depot, 한달지속)가 1989년 최초로 승인받은 이후 PLGA 고분자를 활용하여 지속형 제형으로 개발된 물질은 약 10여 개에 이르고 있다. 그러나 아래 그림 2에서 나타나듯이, 에멀전 방식은 제조 과정 중 가열해서 유기용매(Methylene Chloride)를 휘발시킴으로써 녹아있던 PLGA가 고체화되면서 미립구가 형성되기 때문에 열에 약한 단백질이나 크기가 큰 펩타이드 같은 경우 변성이 일어나서 분자량이 큰 물질의 경우 제조 자체가 불가능하다. 루프론데포의 leuprolide는 아미노산 10개로 이루어져 있으며, Bydureon의 Exenatide는 39개의 아미노산으로 이루어져 있다. 이와 같은 에멀전 방식으로 가능한 가장 큰 분자는 Exenatide와 같은 GLP1 계열일 것으로 추정된다.   펩트론의 SR-DDS 기술인 SmartDepot은 아래 그림 3과 같이 몇 가지 부분에서 에멀전 방식보다 더 뛰어나다. 1) 에멀전 방식에서 사용되는 것과 같은 독성이 강한 유기용매(Methylene Chloride)가 아닌 식초의 주성분인 아세트산(Acetic acid)을 용매로 사용하며, 2) 유기용매를 휘발시키기 위한 가열과정이 없기 때문에 펩타이드 변성이 방지되며, 이로 인해 에멀전 방식보다 분자량이 큰 펩타이드의 지속형 제형 개발도 가능하다. 즉 GLP1보다 분자량이 큰 인슐린(아미노산 50개)도 기존 에멀전 타입보다 높은 수율로 개발 가능하다. 3) 초음파 노즐을 통해 균일한 입자크기 구현이 가능하고 재현성이 우수하다. 또한 초음파 노즐을 조절함으로써 작은 입자 사이즈로도 생산 가능하다. 4) 에멀전 방식에서는 서로 섞이지 않는 물(펩타이드 용매)과 유기용매(PLAG 용매)를 물리적으로 섞는 작업이 필요하기 때문에 펩타이드와 PLGA가 균일하게 섞이지 못하고 스케일 업의 한계가 존재하나, 펩트론 방식은 펩타이드와 PLGA 용매가 모두 아세트산으로 같기 때문에 두 물질이 균일하게 분포될 수 있고 상대적으로 쉽게 스케일 업이 가능하다.  최초로 성장호르몬의 서방형 제제를 개발한 LG생명과학의 가장 큰 실패요인은 주사바늘 크기였다. 서방형 Sustained release 방식은 몸 속에서 미립구가 서서히 녹으면서 유효물질이 몸 속으로 방출되는 시스템이기 때문에 물리적으로 물질의 크기가 굉장히 크고 이로 인해 주사바늘 크기 또한 일반 단백질 제제에 비해 크다. 주 1회 GLP1 제형으로 시장에 가장 먼저 출시된 Bydureon이 1일 제형인 Victoza보다도 못한 저조한 매출액을 기록하는 이유는 유효물질인 Exenatide(byetta)와 Liraglutide(Victoza)의 근본적인 차이점도 있지만, 23게이지나 되는 바이듀리온의 주사바늘 크기도 기여한 바가 컸다. 참고로 주사바늘 게이지는 그림 4,5에서 보여지듯이 숫자가 작을수록 주사바늘의 크기가 크다. 바이듀리온보다 2년 뒤 출시된 일라이릴리사의 트룰리시티(Trulicity)의 시장 점유율이 크게 확대된 이유는 주사바늘 크기가 1일 제형과 큰 차이가 없어서 투약의 편의성이 증대되었기 때문이다. (물론 바이듀리온에서 나타난 위장관질환 및 소화불량과 같은 부작용도 트룰리시티에서는 크게 개선된 부분도 있다.  공장완공으로 SmartDepot 기술의 확장 가능성 제고 생분해성 고분자를 이용 미립구 방식의 sustained release 지속형 방식은 가장 손쉽게 펩타이드를 지속형 물질로 개발할 수 있는 방식이다. 생체 내에서 지속형 특징을 보유한 각종 단백질(예를들어 Fc 등과 같은 단백질)을 접목하는 방식은 유전자 단계부터 변형시켜야 하고, 지속형 단백질을 접합하면서 원래 펩타이드의 구조가 변형된다는 점에서 효능 및 안전성이 기존의 펩타이드와 동일하다고 볼 수 없다. 생산에 있어서도 만약 동물세포 배양을 이용한 방식이라면, 생산성이 높은 세포주를 선별해야 하는 작업부터 시작해야 하기 때문에 개발 기간이 오래 소요될 수 있는 단점이 있다. 그러나 미립구 방식의 sustained release 방식은 기존의 펩타이드와 생분해성 고분자를 물리적으로 혼합해서 크기가 큰 미립구를 제작, 이 미립구가 체내에서 서서히 펩타이드를 방출시키기 때문에 기존 펩타이드 원래 고유의 형태를 그대로 유지할 수 있다. 당연히 유전자 단계부터의 조작이 필요하지 않기 때문에 개발기간도 상대적으로 짧으며, 세포배양 생산방식이 아니기 때문에 생산 단가 측면에서도 경쟁 우위에 있다고 볼 수 있다. 아래 표 3에서 확인할 수 있듯이, 글로벌 제약사들은 당뇨 비만 치료제를 타겟으로 각종 호르몬 유래의 펩타이드 제제들을 개발하고 있다. 그러나 호르몬의 특성 상 반감기가 짧기 때문에 지속형 기술들의 접목이 시도되고 있다. 펩트론의 SmartDepot 기술은 기존 에멀전 방식 대비 적용 가능한 펩타이드 크기도 더 크고, 상업화 시 최대 난관이었던 주사바늘 크기도 작게 개발 가능하다는 점에서 기존 기술 대비 우위성을 확인할 수 있다. 이와 같은 sustained release 방식에 대한 글로벌 제약사들의 니즈가 높음에도 불구하고 펩트론의 한계는 그들의 기술을 구현할 수 있는 생산시설이 부재했다는 점이었다. 펩트론의 플랫폼 기술인 SmartDepot 기술을 구현할 수 있는 오송 SR1 공장이 완공된 현재 글로벌 제약사들과 펩트론의 본격적인 collaboration이 시작될 것으로 기대된다. 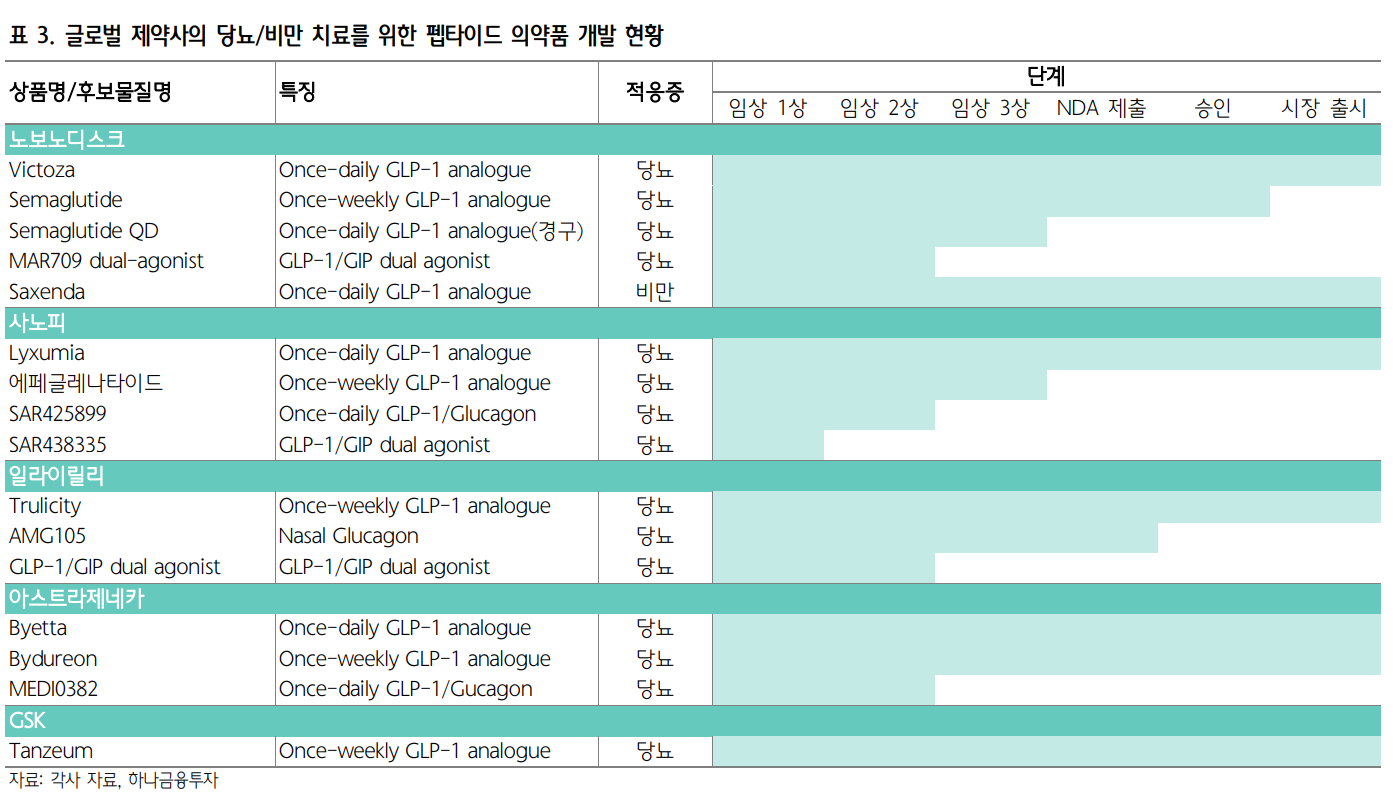 - 펩트론 홈페이지  생분해성 고분자를 이용 미립구 방식의 sustained release 지속형 방식은 가장 손쉽게 펩타이드를 지속형 물질로 개발할 수 있는 방식이다. 생체 내에서 지속형 특징을 보유한 각종 단백질(예를들어 Fc 등과 같은 단백질)을 접목하는 방식은 유전자 단계부터 변형시켜야 하고, 지속형 단백질을 접합하면서 원래 펩타이드의 구조가 변형된다는 점에서 효능 및 안전성이 기존의 펩타이드와 동일하다고 볼 수 없다. 생산에 있어서도 만약 동물세포 배양을 이용한 방식이라면, 생산성이 높은 세포주를 선별해야 하는 작업부터 시작해야 하기 때문에 개발 기간이 오래 소요될 수 있는 단점이 있다. 그러나 미립구 방식의 sustained release 방식은 기존의 펩타이드와 생분해성 고분자를 물리적으로 혼합해서 크기가 큰 미립구를 제작, 이 미립구가 체내에서 서서히 펩타이드를 방출시키기 때문에 기존 펩타이드 원래 고유의 형태를 그대로 유지할 수 있다. 당연히 유전자 단계부터의 조작이 필요하지 않기 때문에 개발기간도 상대적으로 짧으며, 세포배양 생산방식이 아니기 때문에 생산 단가 측면에서도 경쟁 우위에 있다고 볼 수 있다. 아래 표 3에서 확인할 수 있듯이, 글로벌 제약사들은 당뇨 비만 치료제를 타겟으로 각종 호르몬 유래의 펩타이드 제제들을 개발하고 있다. 그러나 호르몬의 특성 상 반감기가 짧기 때문에 지속형 기술들의 접목이 시도되고 있다. 펩트론의 SmartDepot 기술은 기존 에멀전 방식 대비 적용 가능한 펩타이드 크기도 더 크고, 상업화 시 최대 난관이었던 주사바늘 크기도 작게 개발 가능하다는 점에서 기존 기술 대비 우위성을 확인할 수 있다. 이와 같은 sustained release 방식에 대한 글로벌 제약사들의 니즈가 높음에도 불구하고 펩트론의 한계는 그들의 기술을 구현할 수 있는 생산시설이 부재했다는 점이었다. 펩트론의 플랫폼 기술인 SmartDepot 기술을 구현할 수 있는 오송 SR1 공장이 완공된 현재 글로벌 제약사들과 펩트론의 본격적인 collaboration이 시작될 것으로 기대된다. |
* 플랫폼 기술의 확장으로 기업가치 제고 기대 - 하나증권 (2017.09.11)
| 1. 가장 Old한 기술이 가장 Safe할 수 있다 1) 인슐린 개발의 어려움 인슐린이라는 호르몬의 특성 2016년 12월 29일 한미약품이 사노피로 기술이전했던 LAPS-Insulin115가 반환되었다. 기술이전 규모가 크고 기대가 컸던 물질이었던 만큼 시장의 충격도 컸었다. 한미약품측은 아직도 LAPS-Insulin115가 왜 반환되었는지 명확한 이유를 설명하고 있지 않다. 그러나 실제 인체 내에서 섭취한 혈당에 의해 매우 빠른 시간 내에 작용하고 사라져 버리는 인슐린이라는 호르몬의 특성을 고려하면, 초기 과량으로 투여된 인슐린에 의해 저혈당과 같은 부작용이 발생될 가능성이 있고 이러한 점은 지속형 인슐린을 개발하고 있는 기업들에게는 가장 큰 난관 중 하나라고 할 수 있다. 그림 2에서 나타난 것처럼 1주일 지속형 인슐린은 1주 지속을 위해 다량 투입되는 투여 시점에 환자의 혈당보다 인슐린이 과량으로 투입될 경우 저혈당과 같은 부작용이 발생하기 쉽다. 이러한 저혈당 부작용 이슈는 심지어 1일 지속되는 기저인슐린에서도 이슈가 되는 문제이기도 하다. 올해 6월 미국당뇨병학회(ADA)에서 발표된 연구 중 가장 주목을 끌었던 연구는 현재 시장에서 1일 제형으로 시장에서 경쟁하고 있는 사노피사의 란투스(Lantus)와 노보노디스크사의 트레시바(Tresiba)를 비교한 DEVOTE 연구라 할 수 있다. 심혈관 질환 이력이 있는 7,637명의 제 2형 당뇨병 환자를 대상으로 두 인슐린을 비교한 결과 트레시바가 란투스 대비 저혈당 개선효과가 더 뛰어난 것으로 입증되었다. 중증 저혈당 발생률은 2년간의 투여기간 동안 트레시바는 4.9%, 란투스는 6.6%로 트레시바가 란투스 대비 40% 낮은 것으로 조사되었다. 그 외에도 야간 중증 저혈당 발생률도 트레시바가 54% 더 낮았으며, 1회 이상 중증 저혈당을 경험한 환자도 27% 가량 낮았다. 이와 같이 인슐린 개발과 관련된 부작용에 있어서 가장 중요한 문제는 저혈당 발생으로 시판 후에도 이와 같은 추적조사 및 비교임상들이 꾸준히 수행되고 있다.   2) 주 1회 제형 인슐린 개발 현황 이와 같은 부작용 이슈 때문에 인슐린을 지속형으로 개발하는 것은 매우 어려운 일이며, 많은 지속형 기술이 개발되어 있음에도 불구하고 파이프라인에 지속형 인슐린을 개발하고 있는 기업은 손에 꼽을 정도이다. 표 2에서 확인할 수 있듯이 지속형 기반기술을 보유한 기업들이 지속형 인슐린 개발을 시도하였으나 개발 중 속속 중단하였으며, 현재 개발이 진행되고 있는 회사는 당뇨병 치료제 강자인 노보노디스크사와 미국의 바이오벤처인 앤트리아바이오사(AntriaBio) 뿐이다. 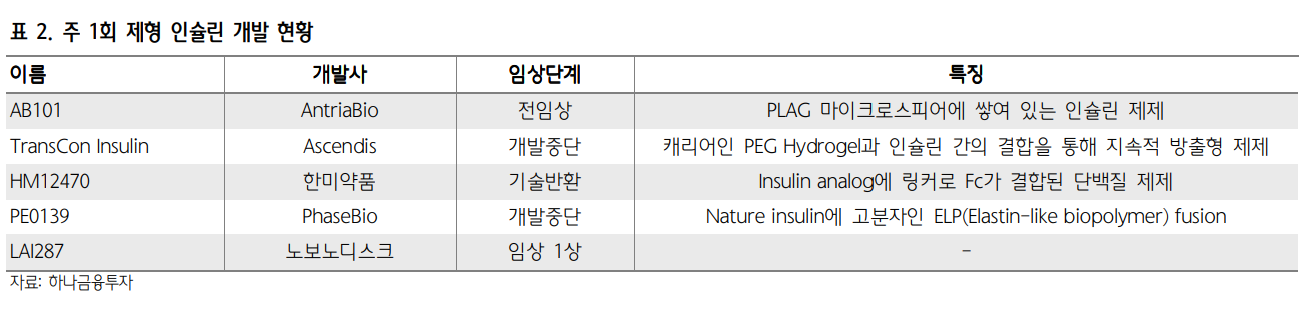 이 중 앤트리아바이오는 올해 7월 국내 제약사인 일동제약과 아주악품, 그리고 메디치인베스트번트로부터 총 1,300만 달러 규모의 투자를 받은 것으로 보도되면서 시장의 주목을 받았다. 올해 6월 미 FDA에 임상 1상 승인신청서(IND)가 제출됐으며, 아마도 곧 본격적인 환자 투여가 시작될 것으로 예상된다. 앤트리아바이오는 자연계 인슐린의 말단에 저분자의 PEG(Polyethylene Glycol)을 붙이고 이렇게 PEGylated 인슐린을 고분자 폴리머인 PLAG(poly-lactic co glycolic acid)와 함께 에멀전(Emulsion)으로 만들어 균일한 미립구(Microspheres) 형태로 지속형 제제를 완성하게 된다. 즉 미립구 형태가 1주 지속을 가능하게 하며, PEGylation을 통해 체내로 방출된 인슐린이 빠르게 분해되지 않고 기저 인슐린으 로써 역할을 할 수 있게끔 하는 원리이다.  인슐린의 저혈당 부작용을 고려했을 때 1주 제형의 Ultra Long acting 형태의 인슐린을 개발하기 위해서는, 약물의 안전성을 증가시키기 위해 원래 분자에 특정 물질은 붙여서 변형시키는 Long acting 방식보다는, 초기 과량 투입되는 효과를 최대한 억제시키고 일정한 속도로 꾸준히 방출되는 sustained release 방식이 더 적합한 방식으로 판단된다. 그리고 이러한 부분은 sustained release 방식의 지속형 플랫폼 기술을 보유한 펩트론에 대해 우리가 주목해야 하는 이유라 할 수 있다.  2. 펩트론 플랫폼 기술 1) SR-DDS: SmartDepot 펩트론 기반기술 SR-DDS 펩트론의 기반기술의 컨셉은 Sustained release, 즉 서방형 기술로 생분해성 고분자(예를들면 PLAG)를 캐리어로 이용하여 미립구(microsphere) 형태로 제조, 약물 방출을 조절하는 기술이다. 약물의 구조변형 없이 지속 방출이 가능하다는 점에서 일반적인 Long acting 방식으로 약물의 크기를 늘리기 위해 PEG와 같은 고분자를 붙이거나, 항체의 Fc를 붙여서 생체 내 지속시간을 증가시키는 원리를 활용하는 기술과는 다르다.  Sustained release 서방형 방식의 가장 고전적인 방법은 에멀전(emulsion) 타입으로 에멀전 방식으로 미립구를 만들어 서방형 제제 기술을 보유한 대표적인 기업으로는 타케다(Takeda)와 알커머스(Alkermers)사가 있다. 타케다사의 SR 기술이 접목되어 미 FDA로부터 한달 제제로 승인받은 루프론데포(Lupron Depot)가 1989년 최초로 승인받은 이후 PLAG 고분자를 활용하여 지속형 제형으로 개발된 물질은 약 10여 개에 이르고 있다. 그러나 아래 그림 6에서 나타나듯이, 에멀전 방식은 제조 과정 중 가열해서 유기용매(Methylene Chloride)를 휘발시킴으로써 녹아있던 PLAG가 고체화되면서 미립구가 형성되기 때문에 열에 약한 단백질이나 크기가 큰 펩타이드 같은 경우 변성이 일어나서 분자량이 큰 물질의 경우 제조 자체가 불가능하다. 루프론데포의 leuprolide는 아미노산 10개로 이루어져 있으며, Bydureon의 Exenatide는 39개의 아미노산으로 이루어져 있다. 이와 같은 에멀전 방식으로 가능한 가장 큰 분자는 Exenatide와 같은 GLP1 계열일 것으로 추정된다.  펩트론의 SR-DDS 기술인 SmartDepot은 아래 그림 7과 같이 몇 가지 부분에서 에멀전 방식보다 더 뛰어나다. 1) 에멀전 방식에서 사용되는 것과 같은 독성이 강한 유기용매(Methylene Chloride)가 아닌 식초의 주성분인 아세트산(Acetic acid)을 용매로 사용하며, 2) 유기용매를 휘발시키기 위한 가열과정이 없기 때문에 펩타이드 변성이 방지되며, 이로 인해 에멀전 방식보다 분자량이 큰 펩타이드의 지속형 제형 개발도 가능하다. 즉 GLP1보다 분자량이 큰 인슐린(아미노산 50개)도 기존 에멀전 타입보다 높은 수율로 개발 가능하다. 3) 초음파 노즐을 통해 균일한 입자크기 구현이 가능하고 재현성이 우수하다. 또한 초음파 노즐을 조절함으로써 작은 입자 사이즈로도 생산 가능하다. 4) 에멀전 방식에서는 서로 섞이지 않는 물(펩타이드 용매)과 유기용매(PLAG 용매)를 물리적으로 섞는 작업이 필요하기 때문에 펩타이드와 PLAG가 균일하게 섞이지 못하고 스케일 업의 한계가 존재하나, 펩트론 방식은 펩타이드와 PLAG 용매가 모두 아세트산으로 같기 때문에 두 물질이 균일하게 분포될 수 있고 상대적으로 쉽게 스케일 업이 가능하다.  2) 주사바늘 사이즈 미립구 기술의 한계는 큰 주사바늘 최초로 성장호르몬의 서방형 제제를 개발한 LG생명과학의 가장 큰 실패요인은 주사바늘 사 이즈였다. 서방형 Sustained release 방식은 몸 속에서 미립구가 서서히 녹으면서 유효물질이 몸 속으로 방출되는 시스템이기 때문에 물리적으로 물질의 크기가 굉장히 크고 이로 인해 주사바늘 크기 또한 일반 단백질 제제에 비해 크다. 주 1회 GLP1 제형으로 시장에 가장 먼저 출시된 Bydureon이 1일 제형인 Victoza보다도 못한 저조한 매출액을 기록하는 이유 는 유효물질인 Exenatide(byetta)와 Liraglutide(Victoza)의 근본적인 차이점도 있지만, 23게이지나 되는 바이듀리온의 주사바늘 사이즈도 기여한 바가 컸다. 참고로 주사바늘 게이지는 그림 8,9에서 보여지듯이 숫자가 작을수록 주사바늘의 사이즈가 크다. 바이듀리온보다 2년 뒤 출시된 일라이릴리사의 트룰리시티(Trulicity)의 시장 점유율 확대를 기대하는 이유는 주사바늘 크기가 1일 제형과 큰 차이가 없어서 투약의 편의성이 증대되었기 때문이다. (물론 바이듀리온에서 나타난 위장관질환 및 소화불량과 같은 부작용도 트룰리시티에서는 크게 개선된 부분도 있다.)   펩트론의 SmartDepot 방식은 초음파 노즐을 조절함으로써 입자 크기 조절이 가능한 특징이 있다. 따라서 균일한 입자 사이즈와 더불어 점점 기술이 진보할수록 미립구 사이즈 또한 작게 만들 수 있다. 펩트론도 초기 25게이지에서 출발해서 현재 30게이지로 주사바늘 사이즈를 점점 줄이고 있다. 일반적으로 예방주사가 26~28 게이지, 인슐린은 30~31 게이지의 주사바늘을 사용하는 것을 고려하면 펩트론이 개발한 30 게이지의 미립구는 PLAG 고분자를 이용한 미립구 방식의 SR-DDS 기술의 한계를 극복한 것으로 볼 수 있다. 3. 펩트론 파이프라인 1) 신약개발 파이프라인 펩트론은 기반기술인 SmartDepot을 적용하여 신약부터 서방형 제형의 제네릭까지 다양한 파이프라인을 보유하고 있으며, 이들 중 특허가 만료된 서방형 제형인 타케다사의 루프론데포와 노바티스사의 산도스타틴은 제네릭으로 개발하여 이미 품목허가를 획득하였다.  지속형 GLP1 제형은 이미 시장에 바이듀리온(아스트라제네카), 탄지움(GSK), 트룰리시티(일라이릴리) 3개의 제품이 출시되었고, GLP1 중 가장 많은 매출액을 기록한 노보노디스크사의 빅토자 지속형 제형인 semaglutide가 NDA를 제출하고 최종 시판허가를 기다리고 있다. 이러한 사실로 미루어 볼 때 펩트론의 파이프라인 중 GLP1 지속형 제형은 그리 큰 매력은 없어 보인다. 그러나 최근에 허가를 받은 탄지움, 트룰리시티와 곧 허가 예정인 세마글루타이드의 경우 각각 알부민, Fc, 지방산 등 약물을 안정화 시키는 물질을 결합한 방식으로 최대 1주간 지속 가능하나, 펩트론의 SR-DDS 방식은 미립구의 사이즈를 조절하거나 생분 해성 고분자의 배합을 조절함으로써 최대 1달간 지속 가능한 기술이다. 더불어 아직 후보물질 도출단계로 매우 초기 단계에 있지만, 앞에서 언급한 바와 같이 인슐린의 분자 특성 상 1주 지속형으로 가장 적합한 기술은 생분해성 고분자를 활용한 미립구 방식이라 할 수 있다. 펩트론은 현재 몇 개의 지속형 인슐린 제형 후보물질을 도출하였으며, 동물실험을 통해 후보물질을 최적화하는 단계에 있다. 동물실험에서 초기 투여시 과량의 인슐린 투여로 인한 인슐린 피크 없이 일주일이 지속되는 PK만 제대로 나온다면 임상 1상 진 입은 시간문제일 것으로 사료된다. 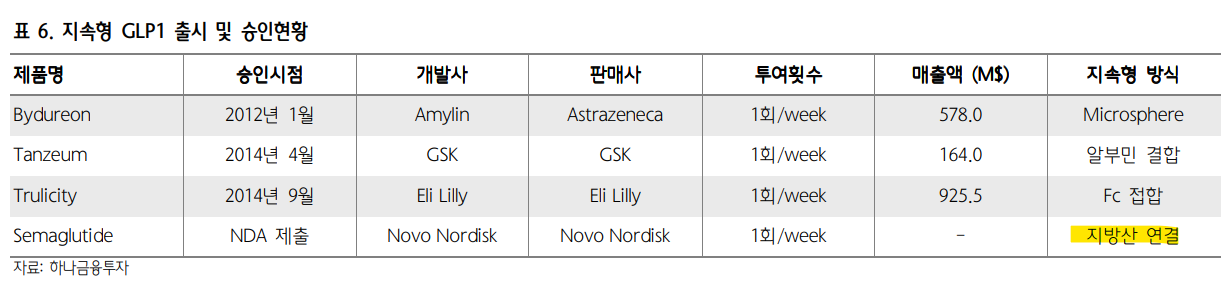 2) GLP1이 파킨슨병 치료제? 8월 3일 저명한 의학저널인 The Lancet에 일주일 제형의 Exenatide 즉 바이듀리온이 파킨슨 병 치료에 효능이 있었다라는 임상결과가 논문으로 발표되면서 시장의 주목을 끌었다. 이임상은 런던대학교 신경학과의 Thomas Foltynie 교수가 수행한 연구자 임상으로 총 60명을 대상으로 운동점수를 비교한 결과, 48주째에 바이듀리온을 투여한 그룹에서는 평균 2.3점 개선된 데 반해 위약군에서는 1.7점 악화되었다. 이것은 비록 연구자 임상이기는 해도 GLP1이 퇴행성 뇌질환에서 질병을 근본적으로 치료한 것을 임상적으로 보여준 첫 사례라 할 수 있다. 특히 이번 임상에서 주목해야 할 부분은 GLP1이 뇌의 BBB(Blood Brain Barrier)를 통과해서 뇌에 직접 작용한다는 점이다. 지속형 제형 중 뇌의 BBB를 쉽게 통과할 수 있는 물질은 SR 기술로 지속성을 구현한 바이듀리온과 펩트론의 GLP1뿐 이라 할 수 있다. 그 외에 제품들은 모두 지속성을 확보하기 위해 GLP1보다 몇 배나 큰 물질을 붙였기 때문에 BBB 통과가 쉽지 않을 것으로 예상된다. 원래 이러한 연구는 미국 NIH에서 동물실험을 통해 GLP1이 신경보호(Neuroprotective) 역할이 있어서 퇴행성 뇌질환 개선효과가 있었음을 입증하면서 시작되었고, 미 NIH는 이에 대한 용도 특허를 출원하였다. 펩트론은 2014년 미 NIH로부터 퇴행성 뇌질환 용도 특허에 대한 전용실시권(전세계 독점)을 확보하였고 NIH와 퇴행성 뇌질환에 대한 공동연구개발(CRADA) 계약을 체결하였다. 현재 펩트론은 국내 식약처로부터 파킨슨 환자에 대한 임상 2상 승인을 받아놓은 상태이다. 내년 상반기 새로 지은 오송공장에서 임상시료 생산이 가능해지면 임상 수행할 것으로 예상된다. (펩트론은 작년 380억원 유상증자를 통해 오송 1공장 건립비 확보. 올해 11월 말 준공식 이후 내년 3월부터 임상시료 샘플 생산 가능) 더불어 란셋에 논문을 게재한 런던대학교 Foltynie 교수 주도의 임상 3상의 약물공급에 대한 논의도 진행하고 있다. 펩트론은 Foltynie 교수가 진행하는 임상 3상이 비록 연구자 임상이라 할 지라도 임상시료 공급을 통해 환자에서의 효능을 입증하여 과학적 데이터를 확보하는 동시에 국내에서 임상 2상을 진행해 파킨슨 치료제로 상업화 및 제품화를 추진할 계획이다. 3) 글로벌 제약사와 기술평가협약 체결 펩트론 기반기술 확장 가능성 펩트론은 지난해 10월 글로벌 제약사와 기술평가협약을 체결하였다. 내용은 글로벌 제약사가 자사의 신규 펩타이드에 펩트론의 SmartDepot 기술을 적용 지속형 당뇨/비만 치료제 개발을 타진한다는 것이다. 펩트론은 올해 초 3가지 제형을 개발했고 지난 5월 글로벌 제약사는 펩트론을 최종 선택했다. 추가 테스트가 내년 2월에 완료되는데 만약 이것이 통과되면 본계약을 체결할 것으로 기대된다. 바로 이러한 부분이 우수한 플랫폼 기술을 가진 회사만의 장점이라 할 수 있다. 현재 당뇨와 비만 시장은 그림 11에서 알 수 있듯이, 각종 호르몬 유래의 펩타이드 제제들이 발굴되고 있으며, 호르몬의 특성 상 반감기가 짧기 때문에 지속형 기술이 반드시 적용되어야 할 부분이다. 펩트론의 SmartDepot 기술은 기존 에멀전 방식 대비 적용 가능한 펩타이드 크기도 더 크고, 상업화 시 최대 난관이었던 주사바늘 사이즈도 작게 조절할 수 있다는 점에서 기술의 우위성을 확인할 수 있다. 이와 같이 글로벌 제약사와의 기술협력으로 펩트론의 SmartDepot 기술이 적용된 성공 사례가 나타난다면, 펩트론 기반기술의 확장 가능성 확인과 더불어 펩트론이라는 회사의 가치도 같이 상승할 것으로 예상된다.  |
* 2018년 1개월형 당뇨치료제 임상시작 주목 - IBK투자증권 (2017.09.11)
| 지속형 제제 기술, 스마트데포 생분해성 고분자를 배합해서 만든 미립구가 약효 지속시간을 연장 생분해성 고분자와 약효물질을 배합해 미립구를 만들면 운반체 역할을 하는 생분해성 고분자가 체내에서 분해되면서 배합되어 있던 약효물질이 몸 속으로 퍼지게 된다. 분해에 걸리는 시간에 따라 약효물질의 확산기간이 조절되므로 지속형 의약품을 개발하는 방식으로 오래 전부터 사용돼 왔다. 분해되는 미립구 재료로 사용되는 물질은 PLGA(poly lactic-co-glycolic acid)다. 생분해성 고분자로 인체에 무해하며 분해되는 수술용 실 등의 재료로 널리 사용 중이다. PLGA는 PLA(poly-lactic acid)와 PGA(poly-glycolic acid)가 중합되어 만들어지는데 PLA의 비율이 높을수록 분해가 안되서 지속성이 증가한다. 이를 통해 지속기간의 조절도 손쉽게 가능하다.  분무건조기술에 초음파 노즐 도입 펩트론은 식품업계에서 안정적으로 사용되는 분무건조기를 이용해 이 미립구를 제조한다. 의약품으로 만들 때는 미립구의 크기가 균일하고 그 크기를 조절 가능한 것이 중요하다. 미립구의 크기가 균일해야 투여시마다 체내 농도가 유사할 확률이 높아 효능의 재현성이 높아지기 때문이다. 농도나 효능의 재현성이 떨어지면 약효를 신뢰할 수 없으므로 임상 통과가 어렵다. 동사는 초음파 노즐을 도입함으로서 정교한 크기 조절을 가능하게 했다. 또한 미립구의 크기는 작을수록 좋은데, 투약의 용이성이 증가하기 때문이다. 가장 먼저 투약 주사기의 바늘을 가늘게 만들 수 있다. 미립구 방식의 의약품은 피하주사제로 투여하는 경우가 많다. 따라서 투약횟수가 적을수록, 투약시 사용하는 주사기 바늘이 가늘수록 환자의 거부감이 적다. 바늘 굵기는 게이지(Gauge, G)수로 표시하는데 숫자가 클수록 가늘다. 일반 주사기 굵기가 23G(외부지름 0.64mm)이며 미립구방식으로 개발돼 1주일 제형으로 판매되고 있는 바이듀레온(Bydureon)이 이 굵기를 사용한다. 동사는 초기부터 25G(외부지름 0.51mm)를 사용가능한 크기로 제조가 가능했었고 지금은 30G(외부지름 0.31mm) 수준까지 굵기를 낮췄다. 30G는 인슐린 투약 시 사용하는 두께로 경쟁제품의 절반수준의 굵기다.  투약 용의성을 증가시키는 두 번째 요인은 사용전 흔드는 횟수가 줄어든다는 것이다. 미립구 방식의 의약품은 가루형태기 때문에 현탁용액 형태로 투여한다. 유통 도중에 약제와 용매의 층분리가 되는 경우가 많아 사용전 주사를 흔들어줘야 하는데 동사제품은 5회로 충분한 반면 바이듀레온은 80회 이상 흔들어야 한다. 아세트산(Glacial acetic acid) 용매를 활용한 Single Phase 제조기술 동사 기술이 의약품 제형기술로 쓰이기 적합한 또 다른 특징은 유기용매 대신 아세트산 용매를 사용한다는 점이다. 기존의 미립구 제조방식으로 널리 사용되는 이중에멀젼(Dual Phase emulsion) 방식은 섞이지 않는 서로 다른 성질의 용액이 필요하다. 용매로 인체에 유해한 유기용매를 사용할 수 밖에 없는 이유다. 그러나 분사건조 방식은 운반체와 약효물질을 동일 용매에 녹여 균일하게 섞는 과정이 필요하다. 오히려 동일한 성질의 용매를 사용해야 한다. 동사가 용매로 사용하는 물질은 아세트산으로 흔히 빙초산으로 불리는 물질이다. 산성이 강하지만 미립구에 잔류하는 경우는 거의 없고 유기용매 대비 독성은 미미한 수준이다.  이를 통해 얻을 수 있는 제제상의 또 다른 장점은 이중에멀젼 방식 대비, 약효물질이 균질하게 퍼져있는 미립구를 얻을 수 있다는 점이다. 동사의 미립구 제조방식은 약효 물질과 운반체를 한 용매에 녹여 고루 섞어준 후 분무하여 건조하는 방식이다. 이중에멀젼은 섞이지 않는 두 용액을 한 용기에 넣고 교반하여 제조한다. 물과 기름을 생각하면 이해가 쉬운데 둘을 섞고 흔들면 물 안에 기름방울들이 생기는 것과 같은 원리다. 이렇게 한 용액 안에 섞여들어간 다른 용액이 후에 미립구가 된다. 설명에서 알 수 있듯이 이중에멀젼 방식은 미립구의 제어가 어렵다. 진동이나 고속교반을 통해 물질들을 섞어줄 때 용액 전체에 균질한 힘을 전달할 수가 없기 때문이다. 크기와 균일도가 일정 범위 내에서 통제되지 않으면 약효물질의 체내 농도나 효능 등 약동학적 특성의 재현성이 떨어져서 임상 성공 확률도 낮아지게 된다. 미립구 제조방식이 오랫동안 사용됐음에도 지속형 약제 개발에 널리 쓰이지 못하는 원인이었다. 제조난도가 높기 때문에 상업화 가능한 수준의 이중에멀젼 방식 제제기술을 보유한 기업은 Takeda와 Alkeme(바이듀레온 개발사) 정도로 파악되고 있다. 로슈의 자회사로 글로벌 대형제약사인 제넨텍도 같은 방식으로 지속형 성장호르몬을 5년간 개발하다가 2004년 생산/제조의 어려움을 이유로 개발을 중단한 바 있다. 동사 방식의 단점은 산성 용매를 사용하기 때문에 산에 약한 원료의약품은 개발이 어렵다는 점이다. 그러나 이로 인해 개발 대상이 크게 제한되는 것은 아니며 현재 펩트론이 개발하고 있는 엑세나타이드나 인슐린에 대해서는 산성용매가 문제가 되지 않는 것을 확인한 상태다. |
* 하반기 기업가치 레벨이 달라질 것 - NH투자증권 (2017.06.22)
| 1. Alkermes의 기술 방향성 Alkermes는 microsphere 기술의 원조격인 회사다. 20년 넘게 Medisorb라는 플랫폼 기술로 microsphere 기반 지속형(long-acting) 제품을 개발해오고 있다. 이미 상용화된 정신분열증 치료제 리스페달콘스타(Risperdal Consta, 2주 1회 제형)와 인베가서스티나(Invega Sustenna, 4주 1회 제형)가 글로벌 마케팅 파트너 얀센을 통해 판매되고 있다. 동사는 Alkermes와 마찬가지로 microsphere 기반 스마트데포(SmartDepot) 플랫폼 기술을 보유하고 있다. 다만 생산 방식에서 Alkermes가 에멀전(emulsion) 방식으로 제조하는 반면, 동사는 분무건조(spray drying) 방식으로 제조하는 차이점이 있다. 에멀전 방식은 microsphere 제조에 가장 보편적으로 쓰이는 방식으로 재현성 있게 반복 제조가 가능한 장점이 있다. 분무건조 방식은 빠르게 대량 제조가 가능한 장점이 있으나 균일한 입자의 제조가 어려운 단점이 있다. 동사는 ‘초음파 노즐’ 등 균일성 확보가 가능한 설비를 제작해 사용 중이다.  리스페달콘스타와 인베가서스티나 모두 리스페리돈을 주성분으로 하는 정신분열증 치료제이다. 먼저 나온 리스페달콘스타는 2주 1회 제형이며, 인베가서스티나는 4주 1회 제형이다. 리스페달콘스타는 vial type으로 동결건조된 분말이 바이알에 분리되어 담겨있기 때문에 사용 전 섞어줘야 하는 불편함이 있다. 인베가서스티나는 액상제형이기 때문에 프리필드주사제 형태가 가능하며 사용 편의성이 높다. 주삿바늘 두께를 보면 리스페달콘스타는 20G로 두꺼우며, 인베가서스티나는 22G로 상대적으로 가늘다. 두 제품의 사례를 통해 Alkermes의 두 가지 기술 방향성을 확인할 수 있다. 1) 월 1회 제형 개발 2) 액상 제형 개발을 통한 주삿바늘 두께 감소이다. 이러한 편의성의 차이는 제품의 매출에 직접적인 영향을 미친다   2. 2014년 Bydureon 리뉴얼 제품 출시의 의미 Alkermes의 원천기술은 아스트라제네카의 Bydureon 개발에도 적용되었다. 2012년 최초로 허가받은 GLP-1 주 1회 제형 Bydureon은 1일 1회 제형인 Victoza 보다 시장에서 성공하지 못했는데, 이는 1)vial type으로 사용 전 섞어야 하는 불편함 2)두꺼운 주사 바늘로 인한 통증 3)임상결과의 열등함 때문이다. 이에 2014년 아스트라제네카는 Bydureon의 pen type을 출시한다. 이후 Bydureon의 매출도 증가하고 있다. microsphere 기술의 단점을 특별한 device 기술을 적용함으로써 보완한 사례에 해당된다. 결국 시장성을 고려한다면 플랫폼 기술과 별개로 device 부분에 대한 전략적 접근이 필요하다.  3. 비만/당뇨 치료제의 기술수출은 플랫폼 기술의 가치 상승과 직결 이미 언론에 보도된 바와 같이, 작년 말부터 글로벌 제약사가 동사의 기술이 접목된 지속형 비만/당뇨 치료제의 기술평가를 진행하고 있다. Microsphere 기술의 경우 근본적으로 액상형이 불가능하므로, 당연히 글로벌 제약사는 이 약점을 device로 보완하는 방향으로 접근할 것으로 예상한다. 비만/당뇨 치료제는 GLP/GCG dual agonist 일 것으로 추정되며 현재 파이프라인 개발을 위해 아스트라제네카, 머크, 사노피, 얀센(한미약품) 등이 경합 중이다. 한미약품-얀센의 기술계약 사례를 보면 1주 제형의 경우 약 1조원의 기술수출도 가능할 것으로 추정되며, 비만 치료제 시장은 2027년 241억 달러에 이를 것으로 전망된다.  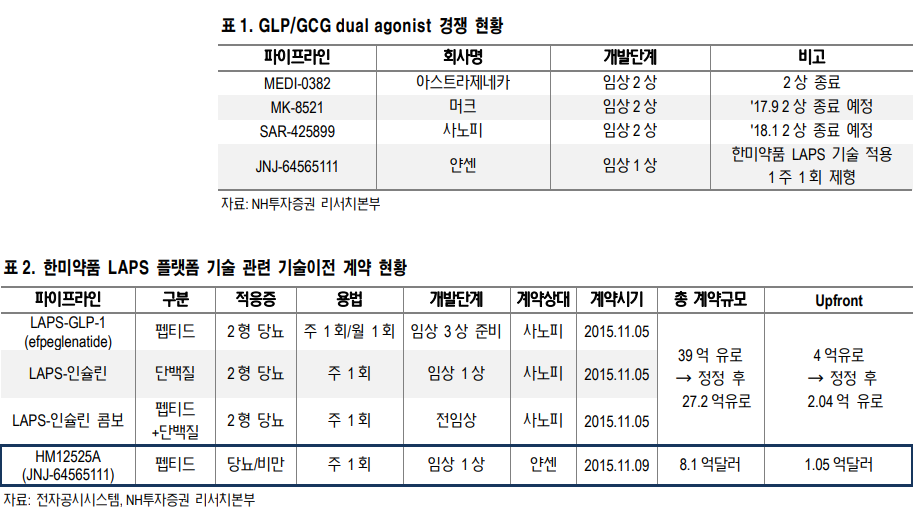 4. 왜 공장이 필요한가? 분무건조기가 아무 제약 공장에나 설치되는 설비가 아니기 때문에, GMP(우수의약품 품질관리제조기준)급 설비를 확보하는 것이 임상시료 생산 및 파이프라인 개발일정에 매우 중요한 요소로 작용하고 있다. 동사는 올해 4분기 완공을 목표로 KGMP급(한국) 오송 1공장을 건설 중에 있고, cGMP급(선진국) 오송 2공장 건설을 계획하고 있다. KGMP급 설비가 가동되는 내년 하반기 주 1회 GLP-1 국내 3상, 월 1회 GLP-1 해외 1상, 파킨슨병 치료제 국내 2상 개시를 기대한다. 또한 비만/당뇨 치료제의 경우 기술수출이 아닌 공급계약 형태가 될 가능성도 있다. 동사에서 직접 제조한 비만/당뇨 치료용 펩티드가 아니기 때문이다. 다만 분무건조를 통한 microsphere 생산은 독자적인 기술이므로, 상용화 이후 제조 매출을 기대할 수 있을 것이다. 한편, 신공장은 기존에 쓰던 장비와 동일한 크기의 장비가 여러 대 설치되어 증설하는 형태이므로 scale-up에 따른 생산이슈가 발생할 확률은 매우 낮을 것으로 전망한다.  5. GLP-1의 신약재창출(drug-repositioning) 전략은 플러스 알파 요인 중장기 파이프라인 중 GLP-1은 적응증을 변경해 신규 파킨슨병 치료제 임상을 준비하고 있다. 국내 2상 IND(임상시험계획) 승인을 받아 놓은 상태에서 역시 공장가동일정에 맞춰 내년 하반기 국내 2상이 본격화 될 것으로 전망한다. 원래 2형 당뇨치료제인 GLP-1을 파킨슨병과 같은 퇴행성신경질환 치료제로 변경한 용도 특허는 NIH(미국 국립보건원) 소유였다. 동사는 이 용도특허의 전용실시권을 NIH로부터 확보했다. 파킨슨 등 뇌 질환 시장으로까지 적응증이 확대되면 스마트데포 플랫폼 기술의 가치는 더욱 확대될 것으로 기대한다. 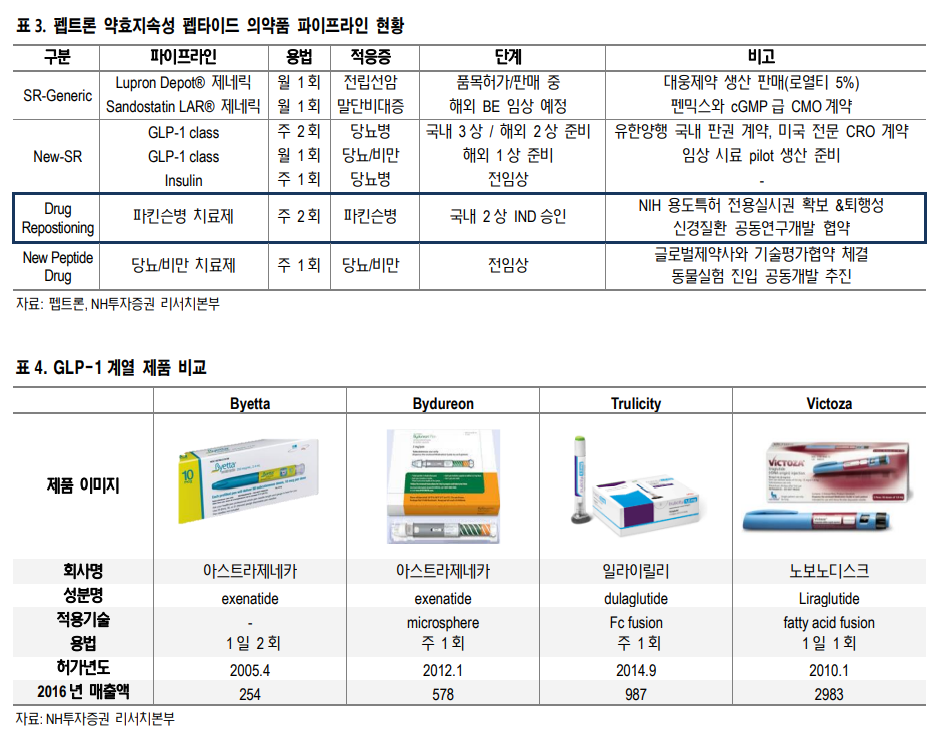  |
* 잘 꿰어질 구슬은 따로 있다 - DB금융투자 (2017.03.28)
| 투자포인트3. 개량신약을 더 개량하여 약점을 보완 미립구(microsphere) 서방화 기술은 약물을 고분자와 섞어 작은 구슬 형태로 만드는 기술이다. 당뇨병치료제 중에서는 이미 아스트라제네카(AZ)에서 판매중인 주1회 GLP-1 바이듀리언®에 적용되어 있다. 바이듀리언®은 주1회 GLP-1 시장에 최초 출시되었음에도 경쟁약물 보다 성장하지 못하고 있는데 그 이유는, 1) 미립구의 크기로 인해 주사바늘이 굵고, 2) 미립구의 분산을 위해 사용전 일정시간 이상 흔들어 주어야 하며, 3) 드물지만 투약 후 주사부위에 덩어리가 생기는 경우가 있어 투약편의성이 떨어지기 때문이다.  펩트론은 초음파 분무기술을 적용하여 바이듀리언®에 적용된 에멀전 타입보다 더 작은 사이즈의 균일한 미립구를 생산할 수 있다. 입자 크기의 감소는 바이듀리언®의 약점을 상당 부분 해소시켜준다. 주사바늘의 두께는 25G로 가늘어졌고, 미립구의 분산이 용이하며, 덩어리가 생길 가능성을 줄여줄 수도 있다. 초음파 분무기술은 연속생산이 가능하고 대량화가 용이하기 때문에 생산시설에 적용하는 시간이 상대적으로 짧고, 비용적 측면에서도 저렴한 장점이 있다.  초음파 분무건조에 사용하는 용매는 아세트산으로 기존 에멀전 타입에 사용하던 유기용매에 비해 훨씬 낮은 독성을 가진다. 대부분의 용매를 휘발시키기 때문에 완제품의 독성 측면에서 두 방식 모두 큰 문제가 되지는 않지만, 아세트산을 사용하면 생산 공정이 보다 수월할 수 있다. |
* 지속형 당뇨치료제 해외임상 자체 진행 준비 중 - 바로투자증권 (2017.01.23)
| 1. 지속성 당뇨병 치료제 임상 자체진행을 위한 준비 순조롭게 진행 중 펩트론은 분무건조기술을 개량해 서방형 제제기술로 활용, 지속형 의약품 개발에 집중하고 있는 회사다. 현재 1 주형만 출시되어 있는 당뇨치료제 GLP1 에 동 기술을 적용, 2 주형과 1 개월형의 신약을 개발 중이다. 2 주형은 유한양행과 함께 국내 임상 2 상을 성공적으로 종료했고 국내 2 상과 해외 2 상을 준비 중이다. 1 개월형은 해외 임상을 준비 중이다. 동 기술은 약효물질에 영향을 거의 주지 않기 때문에 임상 간소화도 가능해서 1 상을 건너뛰거나 1/2 상의 형태로 간소화하는 방안을 준비 중이다. 동사가 지속성 당뇨치료제의 약효물질로 사용하는 원료는 엑세나타이드로 물질특허가 만료된, 기 판매되던 제품이다. 따라서 해외 임상비용도 국내 임상의 2 배 정도에 지나지 않는다. 이를 기반으로 임상을 자체진행 하기로 결정하여 동 파이프라인들의 가치증가가 예상된다. GLP-1 의 시장규모는 미국, 유럽 5 개국, 일본 시장규모만 2014 년 41 억 USD 규모에서 2023 년 89 억 규모로 성장할 것으로 예상되고 있다. 자체 임상진행을 위해 2016 년 부터 세 가지를 준비했다. 첫째, 자금마련을 위해 3 자배정 유상증자를 실행, 총 380 억원을 마련했다. 2016 년 4 월에 결정됐으며 1:1 전환비율의 전환우선주 658,577 주를 발행했다. 당시 발행주식의 10% 수준이었다. 둘째, 안정적인 임상진행을 위해 당뇨병 치료제 임상수탁연구(CRO) 1 위 기업인 프로필사와 임상위탁 계약을 체결했다. 동사의 당뇨병 치료제 파이프라인 전체를 대상으로 임상진행에 대해 논의 중이다. 셋째, 임상시료 생산을 위한 공장 건설을 진행 중이다. 오송의 첨단의료복합단지에 공장부지를 마련했다. 총 25 억원을 지불하고 2017 년 1 월 양수를 마무리했다. 연내 공장을 완공하여 2018 년부터 본격적인 임상에 돌입한다는 계획이다. 3.펩트론 서방형제제 기술, 스마트 데포 포인트는 초음파노즐과 아세트산 용매 분사건조 방식은 미립구 제조기술의 하나로 만들고자 하는 물질을 노즐로 분사, 이를 열풍으로 건조하는 방식이다. 식품산업에서는 오랫동안 사용되어 왔으나 제약업계에서는 잘 사용되지 않았다. 미립구의 크기를 제어하는 것이 어려웠기 때문이다. 미립구의 크기가 일정하지 않으면 확산되는 약물의 농도 역시 균일하지 않기 때문에 약동학적 특성의 재현이나 통제가 불가능하다. 동사는 분사건조기기에 초음파노즐을 장착하여 미립구의 크기조절을 가능케했다. 동 기술의 특허도 보유하고 있다. 미립구에 사용되는 물질은 PLGA(poly lactic-co-glycolic acid)다. 생분해성 고분자로 인체에 무해하며 분해되는 수술용 실 등의 재료로 널리 사용 중인 재료다. PLGA 와 약효물질을 섞어 미립구로 만들면 PLGA 가 분해되면서 원료의약품이 천천히 확산되어 약효가 지속되는 원리다. PLGA 는 조성에 따라 분해속도가 조절되므로 지속성 의약품의 지속기간 조절에 유리하다. PLGA 는 PLA(poly-lactic acid)와 PGA(poly-glycolic acid)가 중합되어 만들어지는데 PLA 의 비율이 높을수록 분해가 안되서 지속성이 증가한다. 동사 기술이 의약품 제형기술로 쓰이기 적합한 또 다른 특징은 유기용매 대신 아세트산 용매를 사용한다는 점이다. 다음 단락에서 설명하겠지만, 기존의 미립구 제조방식으로 널리 사용되는 에멀젼 방식은 섞이지 않는 서로 다른 성질의 용액이 필요하다. 용매로 인체에 유해한 유기용매를 사용할 수 밖에 없는 이유다. 그러나 분사건조 방식은 운반체와 약효물질을 동일 용매에 녹여 균일하게 섞는 과정이 필요하다. 오히려 동일한 성질의 용매를 사용해야 한다. 동사가 용매로 사용하는 물질은 아세트산으로 흔히 빙초산으로 불리는 물질이다. 산성이 강하지만 미립구에 잔류하는 경우는 거의 없고 유기용매 대비 독성은 미미한 수준이다.  에멀전 방식의 단점 미립구 제조에 널리 쓰이던 기존 방식은 에멀전(emulsion)방식이다. 성질이 다른 두 물질을 물리적인 힘으로 섞으면 한 물질 안에서 다른 물질이 미립구를 형성한다. 이것을 에멀전 상태라 부른다. 타케다 사가 가진 이중 에멀전 기술을 예로 들면, 유기용매에 용해시킨 PLGA 와 물에 녹인 약효물질을 섞어 1 차 에멀전을 만든다. PLGA 용액에 약효물질이 에멀전 형태를 이룬다. 이를 PVA(Poly-vinyl alcohol)가 첨가된 물과 한번 더 섞어 이 용액 안에서 PLGA 와 약효물질이 2 차 에멀전 상태가 되도록 유도한 후 유기용매를 증발시킨다. 이후 약효물질과 운반체인 PLGA 가 결합한 미립구를 동결건조해 회수하는 방식이다. 문제는 미립구의 크기나 미립구 내 약효물질의 균일 분포를 제어하기 어렵다는 점이다. 진동이나 고속교반을 통해 물질들을 섞어줄 때 용액 전체에 균질한 힘을 전달할 수가 없기 때문이다. 크기와 균일도가 일정 범위 내에서 통제되지 않으면 약동학적 특성의 재현성이 떨어져서 임상 성공 확률도 낮아지게 된다. 상업적 대량생산 공정에 동 기술을 적용하는 것을 다케다와 노바티스 등 소수의 기업만이 성공한 이유다. 성공적 제품 출시로 기술의 안정성 입증 스마트 데포를 적용해 제조하는 전립선암 치료제 제네릭, 루피어 데포(LUPHERE DEPOT)가 상업적으로 성공함으로써 동 기술의 상업규모 생산 및 안정성에 대한 검증도 마쳤다. 루피어 데포는 대웅제약이 판매하고 있으며 2013 년 매출 106 억원을 기록하고 2014 년에는 150 억의 매출을 기록하며 오리지널 매출을 뛰어넘었다. 동사는 스마트데포를 대웅제약에 기술이전하여 현재 순 매출액의 수 퍼센트에 해당하는 러닝로열티를 수령하고 있다.  |
* 약효지속성 플랫폼 가치에 주목 - 신영증권 (2016.07.20)
 SR-DDS 방식의 ‘스마트데포(SmartDepot)’ 약효지속형 기술은 크게 SR-DDS(Sustained Release Drug Delivery System) 방식과 Modification 방식으로 나뉜다. SR-DDS(Sustained Release Drug Delivery System) 방식이란 약물의 구조변화 없이 지속방출형 제형으로 구현하는 방식이다. SR-DDS는 아미노산이 50개 이하로 구성된 펩타이드에 사용되며, 약물의 변형없이 효능을 유지할 수 있고 6개월까지 지속 성을 확장할 수 있으며, API안정성 등의 일부 임상이 면제되는 장점을 갖고 있다. Modification 방식은 아미노산 50개 이상의 단백질 의약품에 사용되는 방식으로 약물 변형으로 인하여 신물질로 간주되며, 모든 임상을 거쳐야 한다. 펩트론의 스마트데포(SmartDepot)기술은 SR-DDS 방식으로 개발되어 지속성이 높으며 일부 임상이 면제되는 장점을 갖추고 있다. |



