
성공한다면 신약개발 대장주로 등극
임상 성공한다면 침체된 투심 반전가능:
헬릭스미스는 현재 1형 또는 2형 당뇨를 가진 환자 507명이 참여, 무작위 배정하여 25개 임상 사이트에서 PDPN(Painful Diabetic Peripheral Neuropathy, 당뇨병성 신경병증) 유전자치료제 VM202 임상 3-1상을 진행하고 있다.
9월 초 임상 데이터의 모든 숫자와 정보를 수정할 수 없도록 데이터를 락업(Lock-up)하고 9월 말 top-line 데이터를 발표할 예정이다.
침체된 섹터 투자심리 회복을 위해서는 우리나라도 신약 개발능력을 갖췄음을 입증해야 하는데, 유전자치료제는 최근 글로벌 시장에서도 그 가치가 부각되고 있는 만큼 헬릭스미스의 임상성공은 우리나라 신약개발 능력을 한단계 격상시켜 줄 것이다.
한편 회사는 387명을 대상으로 VM202를 0개월, 3개월, 6개월로 3회 투여하고 12개월을 관찰하는 임상 3-2상을 올해 내로 진입할 예정이다.
2020년말경 FDA에 VM202의 일부 적응증에 대한 BLA를 제출하고 두번째 임상을 마친 2021년경에는 전체 적응증에 대한 BLA를 제출할 수 있을 전망이다.
통증치료제를 넘어 근본적 치료제가 되기 위해:
2018년 5월 FDA는 VM202를 RMAT(Regenerative Medicine Advanced Therapy, 재생의학첨단치료제)으로 지정했다.
RMAT은 2016년 12월 FDA에서 제정한 신속허가 프로그램으로서 시장의 미충족 의료수요가 높고 재생의약(regenerative medicine)의 잠재력을 가진 세포 및 유전자치료제를 대상으로 한다.
RMAT으로 지정되면 FDA가 집약적인 가이드를 제공해주기 때문에 심사기간이 단축되고 승인 가능성이 높아진다.
RMAT 지정은 VM202가 단순한 통증치료제를 넘어 근본적 치료제가 될 수 있는 가능성이 있음을 시사한다.
임상 3-2상에서는 monofilament test(바늘을 통한 감각테스트), nerve conduction study(말초신경에 전기자극을 주어 활동전위를 기록), 생체검사 등을 임상 디자인에 추가하여 VM202가 재생의약임을 입증할 계획이다.
이는 VM202의 약가를 크게 인상할 수 있는 근거가 된다.
회사는 VM202의 연 약가를 최소 5만~8만달러로 예상하고 있다.
통증감소의 통계적 유의성을 입증해야:
이번 임상 3상에서는 위약 대비 VM202 의 효능과 안전성을 평가한다.
1차 평가지표는 3개월간의 APS(Average Pain Score, 평균통증지수) 변화이며 2차 평가지표는 3개월간 APS가 50% 이상 감소한 환자비율이다.
보조 평가지표는 1차 평가지표의 6개월 follow-up이다.
임상 2상에서 결정된 최적용량인 8mg(Low dose)의 3개월간 통증개선 결과의 p-value는 0.038이었다.
참여한 환자수는 104명이었다.
이번 임상에서는 환자수가 500명 가까이 늘어났음에도 임상 2상에서 보여줬던 효능의 통계적 유의성을 유지하면 되는 YoY 비교형 임상이다.
한편 현재 PDPN에는 Pfizer의 pregabalin(Lyrica), gabapentin(Neurotonin), Eli Lilly의 duloxetine(Cymbalta) 등 항경련제나 우울증 치료제로 개발되었던 품목들이 오프라벨로 처방되고 있다.
한편 VM202는 기존 통증완화약물에 반응하지 않는 환자들에게 처방되는 일종의 2차 치료제를 목표로 하고 있다.
따라서 이번 임상 3상에서 경쟁약물과의 직접적인 효능비교는 VM202의 임상 통과여부에 영향을 미치지 않는다.
그러나 VM202는 임상 2상 결과에서 pregabalin 대비 통증감소 효과가 다소 높은 것으로 나타났다.
따라서 VM202가 성공적으로 시판될 경우 궁극적으로는 1차 치료제로의 지정도 기대해 볼 만하다는 판단이다.
VM202는 12주 후 통증수치가 3 정도 감소(16mg 기준)한 반면 pregabalin의 임상 4상에서는 12주 뒤 통증감소 수치가 2 정도에 불과한 것으로 나타났기 때문이다.
통증 감소 수치에 대한 기준은 서로 상이할 수 있다.
그러나 두 임상에서 placebo군의 통증감소폭이 유사했기 때문에 효능을 비교해도 큰 무리는 없을 것이란 판단이다.
한편 VM202는 매일 복용할 필요없이 2회 주사로 약 3~9개월간 효과가 지속된다는 강점도 있다.
또한 VM202가 손상된 신경도 복구할 수 있는 재생의약품으로 입증된다면 pregabalin 대비 확실한 경쟁우위를 확보할 수 있을 전망이다.

임상 3상: 통증감소의 통계적 유의성 확인이 목적
임상기간 동안 환자는 0, 14, 90, 104일째 총 4번 투여를 받게 된다.
한번 투여 시 한쪽 종아리당 0.25mg씩 16번, 총 8mg을 투여받는다.
환자 507명 중 252명은 pregabalin, gabapentin 등 기존에 PDPN 환자들에게 처방되고 있는 약을 복용한 경험이 있는 환자들이다.

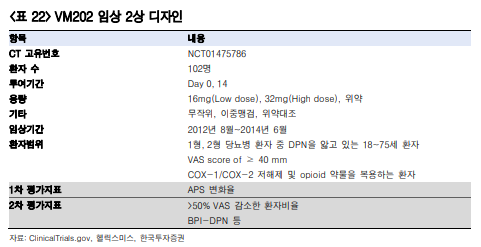
임상 2상: 고용량보다 저용량에서 효능이 우월했음
임상 2상은 총 104명의 환자를 3개군으로 나눠 16mg(Low dose, LD), 32mg(High dose, HD), 위약(Placebo)을 투여했으며 위약 대비 VM202의 효능과 안전성을 평가했다.
임상 기간 동안 0, 14일째 총 2번을 투여했으며 9개월간 관찰했다.
1차 평가지표는 약물투여 후 24시간 내 APS(0~10 사이)의 변화율이며 보조지표는 VAS(Visual Analog Scale) 스코어의 변화, 삶의 질 개선, 통증의 정도를 평가하는 BPI-DPN 등으로 설정했다.
임상 결과 3개월째 통증감소 정도는 HD환자군 -1.9, LD환자군 -3.03, 위약군은 -1.53으로 LD환자군에서의 효능이 더 뛰어났다.
이에 따라 임상 3상에서 LD를 투여하게 된다.
LD투여 3개월 후 결과치에 대한 p-value는 0.038이다.
임상 3상에서는 환자수를 500여명으로 늘린 만큼 여전히 p-value를 0.05 이하로 유지할 수 있을지가 관건이다.

리포트 원문 link : http://hkconsensus.hankyung.com/apps.analysis/analysis.downpdf?report_idx=534918
Investory 인베스토리 텔레그램 메신저 채널에 입장해서 새로운 글 알림 받기 : https://t.me/investory123



