반응형
* 태어난김에 면역 일주: 면역의 개념과 치료제 개발 동향 - LS증권 (2024.09.26)
| 면역 질환은 지난 5년간 의약품 사용량 증가율 측면에서 가장 가파르게 성장한 질환군이다. 시장 규모 측면에서도 항암제 다음의 위치를 차지하고 있는 거대 질환군이다. 뛰어난 효력을 가진 의약품들이 등장하며 시장의 성장을 이끌었으나 여전히 다수의 질환은 치료제가 부재하며 환자들의 Unmetneeds가 존재한다. 빅파마들은 새로운 기전의 면역 질환 치료제를 꾸준히 개발하고 있으며 치료제별로 최적의 적응증을 찾기 위한 노력이 지속되고 있다. 면역 질환 치료제를 넘어 면역 기전이 제약/바이오 산업에서 차지하고 있는 비중은 상당히 크다고 할 수 있다. 바이오 의약품의 상당수가 항체라는 면역 시스템에서 도출된 물질을 기반으로 하며, 면역 관문 억제제를 필두로 하여 항암제의 약 절반 가량이 면역 항암제임을 감안한다면 면역 기전은 의약품 개발에서 가장 핵심이 되는 생물학적 기전이라고해도 과언이 아닐 것이다. 즉 면역에 대한 이해는 신약 개발과 제약/바이오 산업을 이해하는 데 있어서 필수적인 영역이라고 할 수 있겠다.      면역 반응의 분류 선천면역(Innate immunity)과 후천면역 또는 적응면역(Adaptive immunity)은 면역 체계의 두 가지 주요 축으로, 서로 다른 기전과 역할을 수행한다. 선천면역은 병원체가 몸에 침입했을 때 가장 먼저 반응하는 면역체계로, 빠르고 비특이적으로 작용한다. 적응 면역은 특정 병원체에 맞춰 반응하며, 시간이 걸리지만 기억세포를 통해 반복적인 감염에 더욱 강한 방어를 제공한다. 자가 면역 질환에서 선천면역은 주로 염증을 유발하고 질병 초기 단계에서 중요한 역할을 한다. 선천 면역은 손상된 조직에서 발생하는 패턴을 인식하여 염증 반응을 촉진한다. 적응 면역은 주로 자가 항원에 대한 특이적 반응을 통해 조직 손상과 염증을 지속적으로 유도한다. 자가 반응성 T세포는 자가 항원을 인식하여 공격을 주도하고, B세포는 자가 항체를 생성해 신체의 정상 조직을 지속적으로 공격한다. 선천면역과 적응면역은 병원체에 대한 신속한 대응과 장기적인 면역 기억을 통해 몸을 보호할 수도 있지만 자가 면역질환에서는 서로의 면역 반응을 증폭시키며 복잡한 면역 환경을 형성한다.  Innate immunity 선천면역은 비특이적이고 빠르게 작동하는 방어 체계로 인식되어 왔으나, 이후 Pattern recognition receptors(PRRs)를 통해 병원체를 감지하고 반응하는 정교한 기전을 가진 것으로 밝혀졌다. 선천면역의 핵심 요소로는 여러 가지가 있다. 첫째로, 피부, 점막, 그리고 타액 내 효소와 같은 물리적 및 화학적 장벽이다. 이들은 병원체의 침입을 방지하는 1차 방어선 역할을 한다. 둘째로, 대식세포, 수지상세포, NK세포 등의 면역세포들이 주요한 역할을 수행한다. 이들 면역세포는 침입 병원체를 인식하고 제거하며, 염증 반응을 유도한다. 선천면역은 단순히 병원체를 제거하는 것이 아니라, 체내 환경의 변화에도 반응하여 항상성을 유지하는 데 필수적이다. 최근에는 선천면역이 세포 수준에서 기억 능력을 가질 수 있다는 'trained immunity' 개념 또한 대두되고 있다. 이는 선천면역계가 과거 병원체 노출로 인해 향후 재노출 시 더 강한 반응을 보일 수 있다는 것이다. 이는 선천면역이 단순히 초기 방어선으로 기능하는 것에서 벗어나, 면역 반응의 중요한 축임을 의미한다. 면역 세포 활성화 면역 인식(immune recognition)은 병원체 및 손상된 세포를 감지하여 면역 반응을 시작하는 역할을 한다. 이 과정에서 PRR이 핵심적인 역할을 하며, Pathogen-associated molecular patterns(PAMPs), Microbe-associated molecular patterns(MAMPs), Damageassociated molecular patterns(DAMPs) 등을 인식한다. PRRs는 대식세포, 수지상세포 등 다양한 면역세포에 존재하며, 병원체의 특성을 인지하고 즉각적으로 면역 반응을 유도한다. 이 과정은 빠르고 비특이적으로 진행되며, 적응면역이 시작될 때까지 초기 방어를 담당한다. PRRs에는 Toll-like receptors(TLRs), NOD-like receptors(NLRs), C-type lectin receptors(CLRs) 등이 포함되며, 이들 각각은 다양한 병원체 분자를 인식할 수 있는 기능을 가진다. 이를 통해 면역 세포는 병원체가 체내로 침입했음을 감지하고 염증 반응, 인터페론 방출 등을 통해 면역 반응을 가속화한다.  면역 반응 선천 면역의 기전은 다양한 병원체를 제거하기 위해 몇 가지 공통된 원리에 기초하고 있다. 이러한 원리들은 숙주가 병원체를 제거하고 손상된 조직을 회복하는 과정을 촉진하는 역할을 한다. 1)항균 펩타이드와 같은 물질들이 박테리아의 음전하를 띤 세포막을 인식하고 선택적으로 파괴한다. 이는 숙주의 세포막에는 영향을 주지 않고 병원체만 공격하는 방식이다. 2)병원체 자체가 아닌 그들의 독성 인자를 억제하여 감염 능력을 약화시킨다. 예를 들어, 체내 Protease inhibitor가 병원체의 독성 효소를 차단하여 숙주를 보호한다. 3)PRR은 병원체를 인식하여 보체 시스템이나 식세포작용을 활성화시킨다. 이를 통해 병원체는 보체에 의해 파괴되거나 식세포에 의해 섭취된다. 4)병원체에 감염된 세포는 자살을 유도해 스스로 파괴된다. 이는 세포사멸(apoptosis) 또는 염증성 세포사(pyroptosis) 등으로 이루어지며, 병원체가 확산되는 것을 막는다. 5)숙주는 병원체가 필요로 하는 영양소, 예를 들어 철분 등을 차단하여 병원체의 성장을 억제한다. 이를 통해 병원체는 필요한 영양소를 얻지 못해 생존과 번식이 어려워진다.  염증 염증 반응은 조직 손상이나 병원체 침입에 대한 신체의 방어 기작으로, 선천면역 반응의 핵심이다. 염증 반응은 1)혈관이 확장되어 염증 부위로 혈액이 집중 2)혈관 투과성이 증가하면서 혈장이 조직으로 유출 3)염증 부위의 혈류 증가로 인해 체온이 상승 4)염증 매개체가 신경 말단을 자극하여 통증을 유발하는 네 가지의 특징을 가진다. 염증은 병원체 제거와 조직 복구를 위해 면역세포, Cytokine, Chemokine 등의 다양한 신호 분자들이 조절하는 복잡한 과정으로 진행된다. 주요 매개체로는 TNF-α (Tumor Necrosis Factor-alpha), IL-1(Interleukin-1), IL-6, IL-8 (CXCL8) 등이 있다. 이들은 염증 부위로의 면역세포 이동을 유도하고, 혈관 확장과 투과성을 증가시켜 염증 반응을 증폭시킨다. 염증 반응이 진행된 후에는, TGF-β (Transforming Growth Factor-beta)와 IL-10 같은 항염증 사이토카인이 방출되어 염증을 억제하고, 조직 복구가 이루어진다. 호중구는 염증 반응 초기에 가장 먼저 염증 부위로 모집되는 면역세포다. IL-8와 같은 케모카인이 호중구를 염증 부위로 유도하며, 호중구는 병원체를 파괴하기 위해 활성산소와 효소들을 방출한다. 또한, 호중구는 세포 내 과립에 있는 리소좀과 같은 효소들을 분비하여 병원체를 분해한다. 대식세포는 염증 반응에서 가장 중요한 역할을 한다. PRRs를 통해 병원체를 감지하면, 대식세포는 TNF-α, IL-1, IL-6 등을 분비하여 염증을 유발한다. 이들 사이토카인은 다른 면역세포들을 모집하고 활성화하여 염증 반응을 강화한다. 대식세포는 또한 병원체를 포식(Phagocytosis)하여 제거한다. 추후 염증 해소 단계에서는 조직 복구를 촉진하는 M2형 대식세포로 전환된다. 수지상세포는 병원체를 인식하고 이를 항원으로 처리하여 적응 면역을 활성화하는 중요한 역할을 한다. 염증 반응 초기에는 PRRs를 통해 병원체를 감지하고, IL-12 등의 사이토카인을 분비하여 면역세포의 활성화를 유도한다. 수지상세포는 병원체를 포식하고 항원 제시를 통해 T세포를 자극한다. 비만세포는 주로 조직에 상주하며 염증 반응을 촉발하는 역할을 한다. 비만세포는 병원체 감염이나 알레르기 반응에 반응하여 히스타민, Prostaglandin, Leukotriene 등을 방출한다. 이러한 물질들은 혈관 확장과 투과성 증가를 유도하여 염증 반응을 촉진하고, 염증 부위로 면역세포들을 모집한다. ILC(Innate Lymphoid Cells)는 항원에 의존하지 않는 면역 반응을 수행한다. ILC는 감염이나 조직 손상이 발생한 후 수 시간 내에 빠르게 반응하여 염증성 사이토카인을 분비한다. 이로 인해 감염 부위로 면역 세포들이 모이고 염증 반응이 촉진된다. ILC는 주로 세 가지 그룹으로 나뉜다. ILC1은 Th1 세포와 유사한 기능을 하며 바이러스 감염이나 세포내 병원체에 대한 면역 반응을 담당 한다. ILC1은 주로 IFN-γ를 분비하여 대식세포를 활성화하고 감염된 세포를 제거한다. ILC2는 Th2 세포와 유사하며, 알레르기 및 기생충 감염에 대한 반응을 조절한다. 이들은 IL-5와 IL-13을 분비해 호산구의 활성화와 점막 면역을 촉진한다. ILC3는 Th17 세포와 유사하며, 특히 장내 미생물 조절과 관련된 면역 반응에서 중요한 역할을 한다. IL-17과 IL-22를 분비해 점막 면역을 강화하고 장내 항균 반응을 촉진한다. Immune tolerance 선천면역의 Immune tolerance는 공생 중인 미생물과 병원체 등을 구별하고 과도한 면역반응을 방지하는 과정이다. 과도한 면역 반응이 방지되지 않을 경우 자가염증성 질환(auto-inflammatory diseases)이 발생할 수 있다. 이는 선천면역 시스템이 자기 조직을 외부 침입자로 잘못 인식하거나 여러 이유로 인해 과도하게 활성화되는 상태를 의미한다. 대표적으로 NLRP3 또는 NLRC4와 같은 선천 면역 수용체에 돌연변이가 발생하면, 염증 반응이 자극 없이도 지속적으로 활성화되어 자가염증성 질병이 발생할 수 있다. Adaptive immunity 적응면역(Adaptive Immunity)은 선천면역과 달리 특정 항원을 인식해 고도로 특이적인 반응을 일으키며 면역 기억을 통해 재감염 시 더 빠르고 강력한 방어를 제공한다. T 세포와 B 세포가 핵심적인 역할을 하며 이들은 항원을 인식하고 활성화된 후 병원체 제거와 면역 반응 조절에 기여한다.  면역세포 활성화 1) 항원 제시: 병원체가 체내에 침입하면 수지상세포와 같은 항원 제시 세포(Antigen presenting cells, APCs)가 병원체를 탐지하고 이를 처리하여 항원을 분해한다. 이렇게 처리된 항원 조각들은 Major Histocompatibility Complex(MHC)에 결합된다. 항원 조각은 MHC 분자와 결합한 후 세포 표면으로 이동하여 활성화 되지 않은 상태의 Naive 면역 세포에 제시된다. 2) T세포의 항원 인식과 활성화: T세포는 T cell receptor(TCR)를 통해 항원-MHC 복합체를 인식한다. 여기서 MHC 클래스 I은 CD8+ T 세포에, MHC 클래스 II는 CD4+ T 세포에 항원을 제시한다. 그러나 이 항원 인식만으로는 T세포가 완전히 활성화되지 않으며, 추가적인 신호, 예를 들어 CD28과 B7의 상호작용 등이 필요하다. 이 신호는 T세포의 활성을 더욱 증진시키고, IL-2나 IL-12와 같은 cytokine이 T세포의 완전한 활성화를 유도한다. 이후 CD8+ T 세포는 Cytotoxic T cell로, CD4+ T 세포는 Helper T cell로 분화한다. 3) B세포의 항원 인식과 활성화: B세포는 B cell receptor(BCR)를 통해 항원을 인지한 뒤 활성화된다. B세포는 항원을 인식한 후 이를 처리하고, MHC 클래스 II를 통해 CD4+ T세포에게 항원을 제시할 수 있다. 이 과정에서 CD40L-CD40 상호작용과 IL-4, IL-21 등의 Cytokine은 B세포의 완전한 활성화와 형질 전환을 유도한다.  면역 반응 적응 면역은 크게 세포성 면역과 체액성 면역으로 나뉜다. T 세포는 세포성 면역을 주로 담당하고 B 세포는 체액성 면역을 담당한다. 1) CD8+ T 세포는 MHC 클래스 I에 결합된 항원을 인식하고, Perforin과 Granzymes을 분비하여 타겟 세포를 파괴한다. Perforin은 세포막에 구멍을 뚫고 Granzyme은 세포 내에서 Caspase를 활성화시켜 세포의 사멸을 유도한다. 이를 통해 CD8+ T 세포는 감염된 세포를 제거하며 염증 반응 없이 감염을 종식시킨다. 2) CD4+ T 세포는 Cytokine을 분비하여 다른 면역 세포들을 활성화하고 면역 반응을 조절한다. CD4+ T 세포는 Th1, Th2, Th17 등 여러 하위 유형으로 분화할 수 있으며, 각 유형은 서로 다른 사이토카인을 분비한다. 대표적으로 Th1 세포는 IFN-γ를 분비하여 대식세포를 활성화하고, CD8+ T 세포의 세포 독성 활성을 촉진한다. Th2 세포는 IL-4를 분비하여 B 세포를 활성화시켜 항체 생성을 촉진한다. Th17 세포는 IL-17을 분비하여 염증 반응을 유도하고 호중구를 활성화 시킨다. 3) 활성화된 B 세포는 형질세포(Plasma cells)로 분화되어 항체를 분비한다. 항체는 타겟에 결합하여 기능을 막는 중화 작용을 할 수 있다. 또 Opsonization을 통해 대식세포나 호중구가 병원체를 쉽게 포식할 수 있도록 돕거나 항체 의존성 세포 매개 세포독성(AntibodyDependent Cell-mediated Cytotoxicity, ADCC)을 유도하여 NK 세포가 병원체를 직접 파괴하도록 한다. 항체는 보체(Complement) 시스템을 활성화하여 타겟 세포의 세포막을 파괴하거나 식균작용으로 제거할 수 있도록 한다.  Immune Memory 면역 기억은 이전에 노출된 항원에 대해서 더 빠르고 강력하게 반응할 수 있는 능력을 만들어 낸다. 이는 장기적인 보호를 제공하며, 백신의 원리이기도 하다. T세포와 B세포 모두 항원에 다시 노출 되면 면역 기억을 통해 신속하게 활성화되어 타겟을 효과적으로 제거한다. 면역 기억을 담당하는 세포는 오랜 기간 동안 생존하며, 질병의 재발을 방지하거나 선제적으로 증상을 완화시킬 수 있다. 1) T 세포의 Immune memory: Naive T 세포가 항원에 노출된 후 TCR을 통해 신호가 전달되면 T 세포는 활성화되며, IL-2와 같은 Cytokine의 신호를 통해 분열을 시작한다. 이를 통해 동일한 TCR을 가진 T 세포가 대규모로 증식하게 되고 이를 Clonal expansion이라고 한다. Clonal expansion 후 면역 반응이 마무리되면 대부분의 T 세포는 apoptosis를 통해 제거되는 contraction 과정을 거치지만, 일부 T 세포는 기억 T 세포(memory T cells)로 분화한다. 기억 T 세포는 항원에 대한 면역 기억을 유지하고, 향후 재감염 시 더욱 빠르고 강력한 면역 반응을 제공한다. 기억 T 세포는 존재하는 위치, 수명, 능력 등에서 차이가 있는 몇가지 종류로 나뉜다. Central memory T cell(TCM)은 주로 림프절과 같은 2차 림프 조직에 위치하며, 항원에 재노출되었을 때 빠르게 활성화되고 증식할 수 있다. TCM 세포는 높은 수준의 IL-2 생산과 함께 강력한 증식 능력을 갖추고 있으며, 말초 조직에서 effector T 세포로 분화할 수 있다. Effector memory T cell(TEM)은 주로 말초 조직에 분포하며, 즉각적으로 IFN-γ와 같은 cytokine을 분비하여 빠르게 병원체를 제거하는 기능을 수행한다. Tissue-resident memory T cell(TRM)은 주로 폐, 피부, 장과 같은 장벽 조직에 상주하여 즉각적인 면역 반응을 유도할 수 있다. TRM 세포는 조직에 상주하면서 재감염에 신속하게 대응하며, 병원체의 첫 침입 시 조직 내에서 바로 반응을 일으킨다. 2) B 세포의 Immune memory: BCR이 항원과 결합하면 B 세포는 CD4+ T 세포의 도움을 받아 활성화되며, Clonal expansion을 겪으며 형질세포(plasma cell)와 기억 B 세포(memory B cell)로 분화된다. 이 과정에서 대부분의 기억 B 세포는 Germinal center(GC)를 거치는데 이들은 항원에 대한 친화력이 매우 높고, 특정 유형의 항체를 생산할 수 있다. GC에서 B 세포는 Affinity maturation과 Class switch recombination(CSR)을 겪는다. Affinity maturation은 항체의 항원에 대한 결합력을 높이는 과정이며, CSR은 IgM을 생산하는 B 세포가 IgG, IgA, IgE 등 다른 유형의 항체를 생산할 수 있도록 변화하는 과정이다. 이렇게 형성된 기억 B 세포는 매우 작은 양의 항원에도 민감하게 반응하며, 더 빠르게 증식할 수 있는 능력을 가지고 있다. 일부 B 세포는 Long-lived plasma cell(LLPC)로 분화하여 주로 골수와 같은 조직에 자리 잡는다. 이들은 장기적으로 항체를 지속적으로 생산하여 병원체를 제거하거나 감염을 예방한다. LLPC는 항원에 의한 자극 없이 독립적으로 항체를 생산할 수 있으며, 감염이 재발할 때마다 항체를 즉각적으로 공급할 수 있는 능력을 가진다. LLPC의 생존은 APRIL과 BAFF와 같은 신호에 의존하고, 골수와 같은 특정 조직에서 상당히 오랜 기간 생존할 수 있기에 장기적인 면역 기억에 핵심적인 역할을 한다.  Immune tolerance 면역 관용(Immune tolerance)은 자가 항원에 대한 면역 반응을 억제함으로써 자가면역 질환을 방지하는 데 중요한 역할을 한다. 면역 관용은 중추와 말초 두 곳에서 일어난다. Central immune tolerance는 면역 세포의 초기 발달 단계에서 작동하며, 자가 항원에 반응하는 면역 세포를 제거하는 1차 방어선을 제공하고 추후 Peripheral immune tolerance가 자가 면역을 방지하는 2차 방어선으로 작동한다. T 세포와 B 세포 모두 이러한 과정을 통해 자가면역 반응이 방지되며, 각각의 면역 관용이 발생하는 위치와 과정이 다르다. 1) T 세포의 Central immune tolerance: 미성숙 T 세포가 흉선에서 성숙하는 동안, 자가 MHC에 적절하게 결합할 수 있는지 확인 된다. 자가 MHC에 약하게 결합하는 T 세포만이 살아남고, 나머지는 제거된다. 또한 자가 항원에 강하게 반응하는 T 세포는 제거되거나 무반응 상태에 빠진다. 이러한 과정은 자가 항원에 대한 강한 반응을 보이는 T 세포를 성숙 이전에 흉선에서 제거하여 자가면역 반응을 방지한다. 2) B 세포의 Central immune tolerance: B 세포가 골수에서 성숙하는 동안 미성숙 B 세포는 자가 항원에 대해 반응하는지 확인 된다. 이 과정에서 자가 항원에 강하게 반응하는 B세포는 제거되거나 anergy에 이르고, 혹은 BCR을 다시 구성하게 된다. 3) Peripheral immune tolerance: Central immune tolerance가 존재한다고 하더라도 여전히 일부 자가 반응성 세포는 말초 조직으로 이동할 수 있다. 성숙한 면역 세포는 말초 조직으로 이동하게 되는데, 이곳에서 아래와 같은 면역 관용이 추가로 작동하여 자가면역을 방지 한다. a. Anergy:T 또는 B 세포는 자가 항원을 인식하더라도, 보조 시그널이 없다면 완전히 활성화되지 않으며 결국 기능적으로 비활성화된다. b. 탈진(Exhaustion): 면역 반응이 장기간 지속되면 T 세포는 PD-1, CTLA-4, LAG3 등의 억제 수용체를 과발현하며, 결국 면역이 억제된 상태로 남게 된다. 이 상태는 바이러스 감염이나 암과 같은 만성적인 항원 자극 상황에서 흔하게 나타난다. 탈진은 장기적인 항원 자극으로 인해 자가 면역 반응을 억제하는 중요한 역할을 할 수 있다. c. Deletion: T 세포와 B 세포는 항원을 인식한 후, 말초 조직에서 제거되는 과정을 거친다. 특히 자가 항원에 대한 반응성을 보이는 T 세포는 FAS와 같은 수용체를 발현하고 세포 사멸로 이어진다. d. 조절 T 세포(Treg): Treg은 자가 반응성 T 세포와 B 세포를 억제하고, 자가 항원과 분자 유사성을 가진 항원에 대한 면역 반응을 억제한다.   면역질환 치료제 개발 동향 면역 질환의 분류와 치료 자가면역과 자가염증 면역의 과도한 활성화로 인해 발생하는 면역 질환은 일반적으로 다양한 임상적 특징을 공유하지만, 실제로는 각기 다른 면역 기전들이 질병에 관여한다. 자가면역(Autoimmue)을 주요한 기전으로 하는 질환들은 주로 적응 면역계의 오작동에 의해 발생하며, 자가 항체의 생성과 함께 T세포와 같은 항원 특이적 면역세포들이 자가 항원을 공격해 조직 손상을 유발한다. 반면 자가 염증(Autoinflammation)질환은 선천 면역계의 과도한 활성화로 인해 발생하며, inflammasome과 염증성 사이토카인이 질병의 주도적인 역할을 한다. 물론 이러한 기전들이 항상 명확하게 분리 되어 질병을 일으키는 것은 아니다. 일부 질환은 여러 기전을 동시에 가지고 적응 면역과 선천 면역이 모두 과도하게 활성화되어 복합적인 면역 반응을 나타내는 경우도 많다. 연구에 따르면 질병마다 어떤 기전이 더 주도적인 역할을 하는지에 따라 질병의 분류가 시도되어 왔고 이에 따라 환자마다 다른 임상 진행 양상이 확인된다. 따라서 임상 증상이 유사하더라도 각 질환의 면역학적 기전을 정확히 이해하고 그에 맞는 치료 전략을 세우는 것이 필요하다.  Autoinflammatory disease 자가염증 질환(autoinflammatory disease)의 발병 기전은 선천 면역계의 과도한 활성화, 특히 Inflammasome의 직접적 또는 간접적인 조절 이상과 관련이 있다. Inflammsome은 염증 반응에서 중요한 역할을 하는 세포질 내 단백질 복합체로, 감염이나 세포 손상을 감지하여 염증 반응을 일으킨다. 이들은 주로 NLR 계열의 수용체를 통해 PAMP나 DAMP를 인식함으로 염증 반응을 촉진하게 된다. 이후 Caspase가 IL-1과 IL-18 등을 활성화 시키게 되고 활성화된 IL-1은 염증 반응을 유도하는 핵심 Cytokine으로 작용한다. 자가염증 질환은 유전적 돌연변이에 의해 발생하는 경우가 많으며, 상당수가 단일 유전자 이상에서 기인한다. NLRP3, MEFV, TNFRSF1A 등 Inflammasome 관련 유전자의 변이는 자가염증을 유발하는 주요한 원인으로 밝혀졌다. 잘 알려진 유전성 자가염증 질환인 가족성 지중해열(Familial Mediterranean Fever, FMF)은 MEFV 유전자의 변이에 의해 발생한 다. MEFV는 염증성 반응을 억제하는 Pyrin 단백질의 유전자인데 변이가 일어날 경우 Pyrin은 기능을 상실하여 과도한 염증 반응을 유발한다. 한편, 유전적 결함이 없는 경우에도 자가염증 질환은 발생할 수 있다. 이는 감염, 환경적 자극, 스트레스 등에 의해 촉발된다. 이러한 경우, 염증성 사이토카인의 과도한 분비가 지속되면서 만성적인 염증 상태가 유지된다. 국내에서는 샤페론(378800)이 Inflammasome을 타겟하는 약물을 개발 중에 있다.   Autoimmune disease 자가 면역 질환은 유전적 요인과 비유전적 요인의 복잡한 상호작용 하에 발생한다. 적응 면역계의 이상으로 인해 발생하는 자가 항체는 자가 면역 질환의 주요 특징으로 아래와 같은 경로를 통해 세포의 기능을 방해하거나 손상시키고 사멸을 유도하는 등 핵심적인 역할을 한다. 1) receptor agonists: 자가항체는 수용체를 활성화하여 과도한 생리적 반응을 유도하는 경우가 있다. 그레이브스병(Graves’ disease)에서는 자가항체가 갑상선 자극 호르몬 수용체를 활성화하여 갑상선이 과도하게 활성화되고, 그 결과 갑상선 호르몬 과다 분비가 일어난다. 이는 갑상선 기능 항진증으로 이어져 체중 감소, 불안, 심계항진 등의 증상을 초래한다. 2) receptor antagonists: 반대로 자가항체가 수용체에 결합하여 그 기능을 차단하는 경우도 있다. 중증 근무력증(Myasthenia Gravis)에서는 자가항체가 아세틸콜린 수용체(AChR)에 결합하여 신경-근육간 신호 전달을 억제함으로써 근육 약화와 피로를 유발한다. 3) ligand antagonists: 자가항체가 특정 리간드에 결합하여 그 기능을 방해할 수 있다. 일부 면역 결핍증에서는 자가항체가 리간드에 결합하여 면역 반응을 저해한다. 4) cytotoxicity: 자가항체가 세포 표면에 결합하여 세포 파괴를 일으킬 수 있다. 용혈성 빈혈(haemolytic anaemia)에서는 자가항체가 적혈구 표면에 결합하여 적혈구가 파괴되고, 이로 인해 빈혈이 발생한다. 5) 호중구 활성화: 자가항체는 호중구를 활성화시켜 내피세포와 상피세포에 간접적인 손상을 유발할 수 있다. 이는 염증 반응을 일으켜 조직 손상을 가중시킬 수 있다. 6) Acantholysis: 천포창(pemphigus)과 같은 질환에서는 자가항체가 세포 간 접착을 방해하여 피부 세포가 서로 분리되는 현상을 유발한다. 이는 피부에 물집이 생기고, 상처로 이어지는 심각한 피부 손상을 초래할 수 있다.  Immune mediated inflammatory disease 자가 면역 질환의 시작은 자가 항체라고 할 수 있지만 자가 항체가 유도하는 여러 면역 반응을 통해 발생하는 염증 또한 자가 면역 질환에서 중요한 부분이다. 면역 반응에 의해 증폭된 염증성 사이토카인 신호들은 면역세포의 활성화와 증식을 촉진하여 만성 염증 상태를 만들고 더 나아가 국소 조직뿐만 아니라 전신적인 염증 반응을 일으키기도 한다. 결국 자가면역질환과 자가염증질환은 질병을 발생 시키는 세부 기전은 차이가 있더라도, 두 질환군 모두 염증이라는 중요한 공통점을 가진다고 할 수 있다. 면역 질환에서 염증은 핵심적인 역할을 하고 있다는 것은 오랫동안 인식 되어 왔다. 이에 염증을 동반하는 면역 질환들은 immune-mediated inflammatory disease(IMID)로 일컬어지는 질환군으로 분류된다. 전체 인구의 3%가 앓고 있는 이 질환군은 주로 만성적인 염증과 조직 손상을 동반하며, 자가면역 및 염증 반응의 복합적인 기전에 의해 유발된다. IMID는 Rheumatoid arthritis(RA), Inflammatory bowel disease(IBD), Psoriasis(PsO), Spondyloarthritis(SpA), Juvenile idiopathic arthritis (JIA) 등 여러 질환을 포함하며 이들은비슷한 경로의 면역 기전을 가진다. 대표적으로 TNF-α, IL-1, IL-6, IL-17 및 IL-23 등의 사이토카인은 IMID에서 주요한 염증 매개체로 작용하고 있다. IMID에서 특정 면역 경로가 여러 질환에서 공통적으로 나타나지만, 각 질환에 따라 세부적인 기전에는 차이가 있다. 예를 들어, TNF 억제제는 SpA, IBD, PsO 등 여러 질환에서 효과가 있었으나, IL-6 억제제는 RA와 Vasculitis에서만 효과적이었다. 반면, IL-17A 억제제는 PsO와 SpA에서 효과적이지만, RA서는 효과를 보이지 않았다. 이러한 차이는 이들이 비슷한 면역 기전을 갖더라도 각 질환에서 염증과 면역 반응을 유발하는 세부 메커니즘에는 차이가 있음을 시사한다.  면역 질환 치료제 Pipeline in a product 상당수의 면역 질환은 동일하거나 유사한 면역 경로에서 기인한다. 대표적인 Cytokine인 TNF-α는 RA, PsO, IBD와 같은 다양한 질병에서 공통적으로 염증 유발에 중요한 역할을 하고 있기에 TNF-α 저해제는 과활성화된 염증 경로를 억제할 수 있다. 이러한 공통적인 메커니즘을 타깃으로 한 약물은 한가지 적응증에 승인을 받은 뒤 여러 면역 질환에 대한 치료제로 적응증을 확장할 수 있다. 이처럼 면역 질환을 타겟으로 개발된 약물들은 상당수가 하나의 약물이 다양한 질병에 대한 잠재적인 치료 옵션이 될 수 있는 pipeline in a product 특징을 가지고 있다. Pipeline in a product는 개발사에게 중요한 전략적 이점을 제공한다. 개발사는 하나의 약물 개발이 완료되면 추가 적응증을 확보하는 방식으로 개발 비용을 절감하고, 시장 진입 속도를 높일 수 있다. 나아가서 환자들에게는 더 빠르게 새로운 치료 옵션을 제공할 수 있게 된다.  치료제 개발 전략 면역 질환에서 가장 일반적이면서 중요한 치료적 접근법은 염증을 억제하는 것이라 할 수 있다. 이에 오랜 기간동안 corticosteroid와 같이 광범위하게 면역반응을 억제하는 약물이 사용되어왔으나 효력과 부작용 이슈에서 자유롭지 못했다. 하지만 TNF-α와 같은 특정 사이토카인을 억제할 수 있는 치료제가 개발되면서 면역 질환의 치료는 새로운 국면으로 접어들었고 여러 적응증에 사용되며 빠르게 시장 침투를 늘려왔다. 근래에는, 여기서 그치지 않고 적응증별로 차이가 있는 특정 면역 경로만을 타겟하는 접근법이 제시되고 있으며 이에 적응증별로 타겟하는 Cytokine과 하위 signaling pathway가 세분화 되었다. 자가 항체를 타겟으로 하거나 자가 항체를 생산하는 B세포를 타겟으로 하는 접근법 또한 유효하다. FcRn을 통해 체내 IgG를 낮추는 전략은 가장 유망한 접근법으로 꼽히고 있다. Rituximab과 같은 B세포 제거 능력을 가진 약물은 일부 자가 면역질환에서 효력을 보였다. 최근에는 CAR-T, 이중항체 등을 통해 자가항체를 생산하는 B세포를 제거함으로써 자가 항체를 감소시키는 전략이 시도되고 있다. T 세포를 타겟으로 하는 치료법, 특히 기억 T 세포를 타겟으로 한 치료법 또한 개발 중이다. 기억 T세포는 자가면역 질환의 만성화에 기여함에도 불구하고 기존 치료법은 자가 항원에 대한 기억 T세포, 특히 TRM을 완전히 처리하지 못하여, 치료 중단 시 질환이 재발하는 경우가 많다. 예를 들어, 백반증 치료에서 JAK inhibitor는 효과가 있었으나, 치료 중단 후 질환이 빠르게 재발했다. 이는 염증을 직접적으로 일으키는 세포만을 표적으로 하는 것이 아닌, 면역 기억을 조절하거나 제거하는 치료법이 유효한 전략임을 시사한다. Anergy나 Exhaustion과 같은 Immunetolerance 기전을 활용한 면역 억제도 가능하다. 예를 들어, CD28은 T세포 활성화에 중요한 공자극 경로로, 공자극이 없다면 T cell anergy에 빠진다. 이를 차단하는 방법으로 CTLA-4 recombinant protein이 개발되었으며, RA 등에 사용된다. 최근에는 내인성 항원을 제시하는 수지상세포를 통해 자가항원에 반응하는 T세포를 제거하거나 조절 T세포(Treg)로 변환시키는 등의 전략 또한 제시되고 있다. 이러한 치료법들은 면역 질환의 복잡한 발병 기전 하에 각각 특정 면역 경로나 세포를 타겟으로 하여 질병의 경과를 조절하거나 완화하는 데 중점을 두고 있다. 후술할 내용에서는 타겟이나 치료제의 컨셉에 따라 시판/개발 중인 치료제들을 분류하여 다뤄보고자 한다.   Cytokine Cytokine은 면역 반응 조절의 핵심 인자로, 오랜 기간 치료제 개발의 타겟으로 여겨져 왔다. 이들은 서로 유사한 반응 경로를 공유하지만 세부적으로는 서로 다른 세포나 조직에 다양한 방식으로 영향을 미치고 질병의 발병에 있어서도 상당히 복잡한 상호작용을 하고 있다. 따라서 각 질병의 치료 타겟이 되는 Cytokine은 차이가 있기에 많은 치료제들이 개발되었음에도 불구하고 더 나은 치료 옵션을 위해 지속적인 개발이 이루어지고 있다.   TNF-α TNF-α는 염증반응의 핵심 사이토카인으로, 활성화된 대식세포, T 세포, NK 세포 등에서 생성된다. TNF-α는 soluble(sTNF-α) 형태와 transmembrane(tmTNF-α) 두 가지 형태로 존재한다. 형태에 따라 결합하는 수용체, 즉 TNFR1 또는 TNFR2과의 결합에 차이가 있다. TNFR1은 대부분의 조직에서 발현되며, 세포 사멸과 염증성 신호를 전달하는 수용체로 작용한다. 반면, TNFR2는 주로 면역 세포에서 발현되며, 세포 생존과 증식을 촉진한다. TNF-α 저해제는 RA, CD, UC, PS 등 대부분의 자가 면역 질환의 치료제로 사용되고 있다. 약물로는 오랜기간 매출 1위의 자리를 지켜온 Adalimumab (Humira)을 비롯하여 Etanercept (Enbrel), Infliximab (Remicade), Golimumab (Simponi), Certolizumab (Cimzia) 등이 있다. 국내에서는 셀트리온(068270)이 Infliximab SC 제형인 짐펜트라를 미국에 출시하며 시장을 적극 공략하고 있다   IL-1 family IL-1 IL-1은 염증 반응을 조절하는 주요 사이토카인으로, IL-1α와 IL-1β라는 두 가지 주요 형태로 존재한다. 이들은 염증성 질환의 병리학적 과정에서 유사한 역할을 하지만 세부 특성에는 다소 차이가 있다. IL-1α는 세포 내부에 존재하다가 세포가 손상되거나 괴사할 때 방출된다. 따라서 세포 손상 시 즉시 염증 반응을 유도할 수 있기에 초기 염증 반응을 촉진한다. IL-1β는 전구체 형태로 존재하다가 inflammasome에 의해 활성화되어 외부로 방출되고 감염성 자극이나 자가 면역 반응에서의 염증 반응을 조절하는 데 중요하다. 이에 IL1 antagonist는 자가 염증성 질환의 치료제로 사용되어 왔다. 대표적인 약물로는 Anakinra(Kineret), Rilonacept (Arcalyst), Canakinumab (Ilaris) 등이 존재한다. Kineret은 재조합 단백질로, IL-1 수용체에 결합하여 IL-1에 의한 신호 전달 경로를 차단하고 염증 반응을 억제한다. RA 등 자가 면역 질환 치료제로도 사용될 수 있으나 Neonatla-Onset Multisystem Inflammatory Disease(NOMID)에서 선호된다. 또한 BBB를 통과할 수 있어 중추신경계 염증이 있는 환자에게도 유리하다. Arcalyst는 IL-1 수용체의 extracellular domain으로 이루어진 융합 단백질로, IL-1α, IL1β, IL-1Ra가 IL-1수용체에 결합하는 것을 차단한다. Cryopyrin-associated periodic syndrome (CAPS)와 같은 자가염증성 질환에서 사용되며, 반복성 심막염 치료에도 승인받았다. Ilaris는 IL-1β에 특이적으로 결합하는 fully humanized 항체로, CAPS, Systemic juvenile idiopathic arthritis(SJIA), Gouty arthritis 등의 치료에 사용된다. IL-1β만을 타겟으로 하여 염증 반응을 선택적으로 억제하며, 심혈관 질환에서의 염증에도 그 효과가 입증되었다.  IL-18 IL-18은 염증성 사이토카인으로, 여러 면역 세포들을 활성화시키고 IFN-γ 신호를 증폭시킨다. IL-18은 Th1, Th2, Th17의 반응을 모두 촉진할 수 있다. IL-12와 함께 작용할 경우 Th1 면역 반응을 촉진하고, IL-12나 IL-15가 없는 상황에서는 Th2 세포로의 분화를 유도해 IL-4와 IL-13을 생성하게 된다. IL-23과 함께 Th17 면역 반응을 촉진하며 M2 대식세포나 비만세포를 활성화 할 수 있다. IL-18이 염증성 질환에서 보이는 기능과 임상적 중요성은 최근에 와서 더 명확히 드러나고 있으며 이에 여러 antagonist들이 개발 중이다. 임상 단계에서 앞서 있는 파이프라인은 AB2bio의 Tadekinig alfa로 IL-18에 결합하는 단백질인 IL-18BP 기반의 약물이다. Haemophagocytic lymphohistiocytosis (HLH)환자를 대상으로 임상 3상 진행 중이며 2023년 3월 환자 모집을 마친 것으로 보인다. 국내에서는 에이프릴바이오(397030)가 IL-18 antagonist인 APB-R3를 개발 중이다. APBR3는 동사의 SAFA 플랫폼을 적용한 장기지속형 IL-18BP로 2024년 6월 Evommune에 총계약규모 6,558억원, 선급금 207억원으로 기술이전을 한 바 있다. APB-R3는 임상 1상을 완료했으며 아토피 환자를 대상으로 임상 2상 개발 중이다. 그 외에 관심 가져볼 약물로는 Novartis의 MAS-825가 있다. MAS-825는 IL-1β와 IL18을 동시에 타겟하는 이중항체이다. MAS-825는 NLRC4 유전자의 Gain of Function 변이로 인한 자가염증성 질환에 초점을 두고 개발 중이며 현재 임상 2상 단계이다.   IL-33 IL-33는 염증성 사이토카인으로 주로 알레르기 질환과 호흡기 질환에서 중요한 역할을 한다. IL-33은 폐와 같은 장기에서 주로 발현된다. IL-33은 물리적 손상이나 감염으로 인해 활성화되며 세포 외로 분비되어 ST2 수용체에 결합해 염증 반응을 유발한다. 천식이나 알레르기성 염증 환자에서 IL-33 단백질의 발현이 증가하는 경우가 보고되었으며, 이는 해당 질환에서 IL-33의 중요성을 시사한다. 현재 IL-33을 표적으로 하는 약물은 주로 만성 폐쇄성 폐질환(Chronic obstructive pulmonary disease, COPD)의 치료제로 개발되고 있다. Roche는 ST2 항체인 Astegolimab의 임상 3상을 진행 중이며 환자 모집을 완료한 것을 밝혔다. Regeneron의 IL-33 항체인 Itepekimab 또한 임상 3상 진행 중에 있다.  Common γ chain cytokine family IL-2 IL-2는 주로 CD4+ T 세포에서 분비되며 T 세포와 NK세포의 증식과 활성화를 유도하는 사이토카인이다. 특히 T 세포의 증식과 활성화에 핵심적인데 IL-2는 Effector T 세포와 Treg 세포 모두 작용하기에 면역을 활성화 시키는 역할과 억제 하는 역할을 동시에 할 수 있다. 이는 IL-2의 수용체가 Effector T 세포와 Treg 세포에 모두 존재하기 때문이다. IL-2 수용체는 IL-2Rα (CD25), IL-2Rβ (CD122), 그리고 IL-2Rγ (CD132)의 조합으로 구성되며 이들의 조합에 따라 IL-2에 대한 결합 친화도가 달라지게 된다. 수용체가 IL-2Rα, IL-2Rβ, IL-2Rγ로 구성될 경우 가장 높은 친화도로 IL-2와 결합하게 된다. IL-2Rβ와 IL-2Rγ로 구성될 경우 중간 수준의 친화도, IL-2Rα로만 구성될 경우 낮은 친화도를 갖게 된다. IL-2Rα는 T reg에 발현되기 때문에 상대적으로 T reg이 가지고 있는 IL-2 수용체가 IL-2와 높은 친화성을 갖게 된다. 따라서 IL-2가 저농도로 존재할 때에는 T reg이 활성화 되어 다른 면역 세포들의 과도한 활성화를 억제하고 면역 균형을 유지 할 수 있다. 하지만 IL-2의 농도가 일정 수준 이상 증가하게 되면 effector T 세포와 NK세포의 활성을 증폭시킬 수 있고 강력한 면역 반응을 유도한다. 이는 감염이나 암 세포 제거에 중요한 역할을 하지만, 과도하게 활성화될 경우 염증과 자가면역 반응을 초래할 수 있는 원인이 된다. IL-2가 T 세포를 활성화 시킬 수 있는 잠재력과 그 농도에 따라 다양한 면역 반응을 이끌어낼 수 있다는 특성은 IL-2 기반 약물이 다방면에서 이루어진 이유이다. 최근 Cytokine agonist들은 기존 치료제로서의 한계를 극복하기 위해 다양한 엔지니어링 기술이 적용 되고있다. 대표적으로 아미노산 서열의 변경을 통한 수용체 결합 능력 조절, 표적에 선택적으로 작용하는 기술의 개발, 그리고 반감기를 늘리는 방법 등이 있으며 IL-2 또한 해당 기술들이 적용되고 있다. 저용량 IL-2 agonist는 자가면역 질환 치료제로 개발이 시도 되어왔으며 다수의 면역 질환 환자를 대상으로 한 임상 시험에서 Treg 세포 수의 증가를 입증했다. 하지만 저용량 IL-2는 대체로 자가면역 질환의 근본적인 치료보다는 일시적인 증상 개선에 그쳤고 Treg외에 ILC2나 NK 세포와 같은 다른 면역 세포가 저용량 IL-2에 반응하여 오프 타겟 효과를 일으킬 수 있다는 점이 한계로 지적되고 있다. 한편 고용량 IL-2 agonist를 통해 CD8+ T 세포와 NK 세포의 활성화를 촉진해 면역 반응을 강화하려는 시도는 지속 중이다. IL-2가 Treg 세포도 동시에 활성화하여 항암 효과를 저해할 수 있기 때문에 IL-2를 엔지니어링하여 effector T 세포를 선택적으로 활성화 시키는 방향으로 약물이 개발되고 있다. 국내에서는 지아이이노베이션(358570)이 CD80-IL2 agonist를 개발 중에 있다. 동사의 GI-101과 102는 임상 시험에서 면역 세포의 증식과 활성을 유도할 수 있는 것이 확인된 바 있다. ASCO에서 공개된 GI-102의 임상 1/2a 결과에서는 평가 가능한 환자 34명 중 5명(14.7%)에서 PR(부분 반응)이 관찰되었다. 임상에 참여한 환자의 60%가 3가지 이상의 선행 치료를 받은 경험이 있으며, 74.3%의 환자는 ICI 치료를 받은 경험이 있었음에도 불구하고 반응하지 않거나 내성이 생긴 환자들이었다. 이러한 효과는 CD80과 IL2의 시너지에서 기인한다. CD80과 IL-2가 각각의 역할을 하는 것 외에 결합된 세포에서 발현되는 PD-L1과 CD80 단백질의 cis-결합을 통해 IL-2 수용체와의 결합 안정성을 높이고, PD-L1과 PD-1의 결합을 방해할 수 있다. 이외에도, 조절 T 세포의 CTLA-4에 CD80이 결합함으로써, 항원 제시 세포 표면의 CD80/86과 T 세포 표면의 CD28 간 결합을 촉진시킬 수 있다.  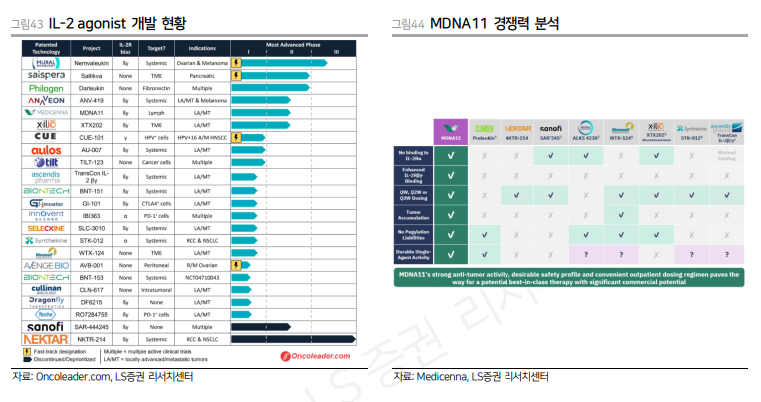 IL-4 IL-4는 B세포의 증식을 촉진하고 생산하는 항체의 클래스를 바꾸는 역할로 발견되었지만, 추후 더 다양한 기능이 밝혀졌다. 특히 IL-4는 Th2 세포의 분화 및 활성화를 유도하고 B세포에서 IgE 생산을 촉진해 알레르기 반응을 유도에 있어 핵심적인 역할을 하고 있다. 대표적인 예시로 IL-4에 의한 과잉 면역 반응은 피부에서 가려움 및 조직 손상을 일으키는 것으로 알려져 있다. 그 외에도 대식세포를 M2 형태로 분화 시킬 수 있는 활성 등을 비롯해 다양한 기능을 가지고 있다. IL-4는 두 가지 유형의 수용체를 통해 신호를 전달한다. 첫 번째는 림프구 및 조혈 세포에서 발견되는 Type I 수용체로 IL-4Rα와 일반적으로 다른 사이토카인 신호에도 관여하는 수용체인 γ chain 수용체로 구성된다. 두 번째는 IL-4Rα와 IL-13Rα1로 구성된 Type II 수용체로, 이 수용체는 주로 조혈 세포가 아닌 세포들에서 발견된다. 이 두 번째 수용체는 IL-13과 IL-4에 모두 반응 하기에 IL-13은 IL-4와 중복된 면역 반응을 일으킬 수 있다. IL-4와 IL-13의 차단은 사노피가 개발한 IL-4Rα 항체, Dupixent의 성공을 통해 아토피성 피부염, 천식 등의 알레르기 질환에서 효과적임이 입증되었으며 그 외에도 다양한 자가면역 질환을 치료할 수 있는 잠재력을 가지고 있는 것으로 판단된다. 이에 사노피는 Dupixent의 적응증 확장을 활발히 진행 중에 있다. Dupixent는 COPD 적응증에 대해 2024년 7월 유럽에서 승인 받은 바 있으며 동 적응증에 대한 FDA의 결정 기한은 2024년 9월 27일로 예정되어 있다. 중국과 일본에서도 2025년 상반기 내에 승인 결과를 확인할 수 있을 것으로 예상된다. 그 외에 만성 부비동염 및 비용종(Chronic Rhinosinusitis with Nasal Polyps)에 대한 심사가 FDA에서 진행 중이며 소아 호산구성 식도염(Eosinophilic Esophagitis, EoE) 적응증 확장에 대한 심사는 유럽에서 진행중이다. BP 임상 3상과 Chronic Spontaneous Urticaria(CSU) 임상 3상도 2024년 하반기 결과가 예상되기에 지속해서 적응증을 확장해 나갈 것으로 보인다. 그 외에 Pfizer는 IL-4/IL-13/IL-33 다중 결합 능력이 있는 항체를 AD 적응증으로 임상 2상 중이며 J&J는 IL4R/IL-31 이중항체인 NM26을 임상 1상 진행 중에 있다.  IL-7 IL-7은 주로 T세포의 생존, 증식, 및 분화에 관여하는 인자로 알려져 있다. 그 외에도 Monocyte의 이동이나 염증성 대식세포 리프로그래밍, 혈관형성 촉진과 같은 염증성 반응을 유발한다. T세포 생존과 증식, Th1/Th17 세포 분화, 그리고 대사활성화에도 중요한 역할을 한다. IL-7은 RA, SLE, PsA, SpA 등 여러 자가면역질환과 연관되어 있으며 특히 RA 환자에서는 높은 수준의 IL-7이 확인된다. 이는 IL-7 antagonist가 자가 면역 질환 치료제로 개발될 잠재력이 있음을 시사한다. GSK는 IL-7 항체인 GSK388130을 자가면역 질환 치료제로 개발 중에 있으며 현재 임상 1상 진행 중이다. 국내에서는 네오이뮨텍(950220)이 IL-7의 T 세포 증폭 능력에 초점을 두고 IL-7 agonist를 개발 중에 있다. 동사의 NT-I7(Efineptakin alfa)은 제넥신(095700)의 장기지속형 플랫폼 hyFc를 적용한 물질이다. 동사는 최근 ESMO에서 NT-I7과 CAR-T 치료제 병용요법에 대한 결과를 발표했다. B림프종(LBCL) 환자에서 CAR-T 치료제를 투여받은 후 21일 후에 NT-I7을 추가로 투여하였다. 안전성은 양호하였으며 CAR-T 치료의 고위험 부작용인 사이토카인 방출 증후군(CRS) 및 면역 관련 신경독성 증후군(ICANS)이 발생하지 않았다. NT-I7 투여 후 CAR-T 세포가 증가 하였고 특히 줄기세포 기억형 T세포 (T cells with stem-cell memory, Tscm) 유형이 유의미하게 증가했다. 그 결과 기존 CAR-T 치료제 대비 증가된 효력을 확인하였다. 중간 결과에서 전체 반응률(ORR)은 81.1%로, 11명 중 9명이 반응을 보였고 이 중 7명은 완전 관해(CR), 2명은 부분 반응(PR)을 보였다. Kymriah의 대세포 B림프종 환자에서의 ORR은 52%로 보고된 바 있다.  ============== 중간 생략 ============== Immune reset B cell depletion 항체 B 세포는 자가 면역 질환에서 자가 항체를 생성하는 세포이기에 가장 핵심적인 원인이라 할 수 있다. 따라서 일반적인 치료제에 의해 질병이 조절되지 않는 난치성 자가 면역 질환에서 B 세포를 아예 없애버리는 B cell depletion 치료는 중요한 치료 옵션이다. 가장 일반적으로 고려되는 치료법은 B 세포 특이적인 마커를 타겟하는 항체 의약품이다. 물론 모든 B 세포를 없애는 것은 체내에 이로운 B 세포를 제거할 수도 있기에 안전성 문제에서 자유로울 수 없다. CD19, CD20, CD22, CD38, BAFF 등이 주요 타겟이며 이들은 B 세포성 혈액암에도 사용된다. CD20은 B 세포의 여러 발달 단계에서 발현되기에 가장 일반적으로 고려되는 타겟이다. Rituxan(rituximab)은 RA, 베게너 육아종증, 미세다발혈관염, 천포창 자가면역 질환 및 혈액암에서 널리 사용된다. 이후 Ocrevus (ocrelizumab), Kesimpta (ofatumumab) 등이 개발되었으며 이들은 더 강력한 활성과 긴 반감기를 보인다. CD19 또한 B 세포 발달의 거의 모든 단계에서 발현되며, Uplizna(inebilizumab)은 신경척수염 스펙트럼 장애(NMOSD) 치료제로 FDA 승인을 받았다. CD22 항체인 epratuzumab은 CD22를 표적으로 하지만, SLE에서 표준 치료와 비교했을 때 뚜렷한 차이를 보이지 않아 임상에서 실패했다. CD38은 형질세포와 일부 B 세포에서 발현된다. CD38 항체인 Darzalex(daratumumab)은 다발성 골수종 치료제로 승인받았지만 난치성 SLE 환자에서도 사용된다. Benlysta(belimumab)은 BAFF 항체로, SLE 치료제로 승인되었다.  ============== 중간 생략 ============== Antibody IgG FcRn FcRn(Fc receptor neonatal)은 IgG에 결합하여, 반감기를 연장하고 면역 기능을 조절하는 역할을 한다. FcRn과 IgG의 결합 비율은 보통 2:1로 이루어지며 pH 의존적이다. FcRn과 IgG간의 상호작용은 pH 5–6에서는 히스티딘의 이미다졸 부분이 양전하를 띠어 FcRn과의 결합이 이루어지고, pH 7.4의 중성 환경에서는 이 결합이 해제된다. 이러한 pH 의존적 결합 메커니즘을 통해 FcRn은 엔도좀 내 산성 환경에서 IgG를 결합하고, 세포 표면의 중성 pH에서 IgG를 방출할 수 있게 된다. FcRn은 산모의 항체가 태아에게 전달 되는 과정에서 핵심적인 역할을 하는 Fc 수용체로 처음 발견 되었으나 현재는 IgG의 반감기를 증가시키는 기능이 더 잘 알려져 있다. IgG는 분자 크기가 크기 때문에 체내에서 배출 되기 어렵고 lysosomal degradation을 통해 분해 되게 된다. FcRn은 IgG의 lysosomal degradation을 막아 IgG의 반감기를 늘릴 수 있다. IgG monomer나 작은 IgG Immune complex(IgG-IC)는 세포 표면의 중성 pH(약 7.4) 상태에서는 FcRn과 결합하지 못하고, pinocytosis를 통해 세포 내부로 들어간다. 이들이 세포 내로 들어오면 early endosome이 형성되며, 이 엔도좀 내부는 산성(pH 약 6.0 이하)이기 때문에 FcRn은 IgG의 Fc 영역과 결합하게 된다. FcRn에 결합된 IgG는 Rab4+ Rab11+ recycling endosome을 형성하고 이 엔도좀은 다시 세포 표면으로 이동하여 IgG를 방출하는 exocytosis 과정을 거친다. 이때 세포 표면의 중성 pH로 인해 FcRn은 IgG와 결합을 해제하고, 재활용된 IgG는 혈류로 방출된다. FcRn에 결합하지 못한 IgG는 lysosome으로 이동해 분해되기 떄문에 결국 IgG의 반감기가 증가되는 효과가 있다. 한편, FcRn은 IgG뿐만 아니라 알부민과도 결합한다. 알부민은 신체 내에서 영양소 운반, 약물 전달 및 체액 균형 유지 등에 역할을 한다. 알부민과의 결합도 pH 의존적으로 이루어지며 이를 통해 알부민의 반감기도 연장 된다. FcRn과 자가면역 질환 대부분의 자가 면역 질환에서 자가 항체가 발견된다는 점을 고려했을 때 IgG의 반감기를 증가시키는 FcRn은 자가면역 질환과 깊은 관계가 있다고 할 수 있다. 특히 중증 근무력증(MG)이나 그레이브스병과 같이 자가 항체의 특성이 명확히 규명되고, 질병의 병인과 직접 관련된 질환들의 경우 같은 질환에서는 그 중요성이 더욱 두드러진다고 할 수 있다. 그 외에도 IBD, RA 등과 같이 복합적인 병리 기전이 존재하는 질환에서도 자가 항체에 의한 염증 반응을 더욱 증폭시킬 수 있다. FcRn은 산모의 항체를 태아로 전달할 수 있기 때문에 태아의 초기 면역 체계를 형성하는 데 있어 중요하지만, 반면에 산모가 자가면역 질환을 앓고 있을 경우 자가 항체가 태아로 전달되어 신생아 루푸스나 신생아 중증 근무력증 등의 질환을 유발할 수 있다. 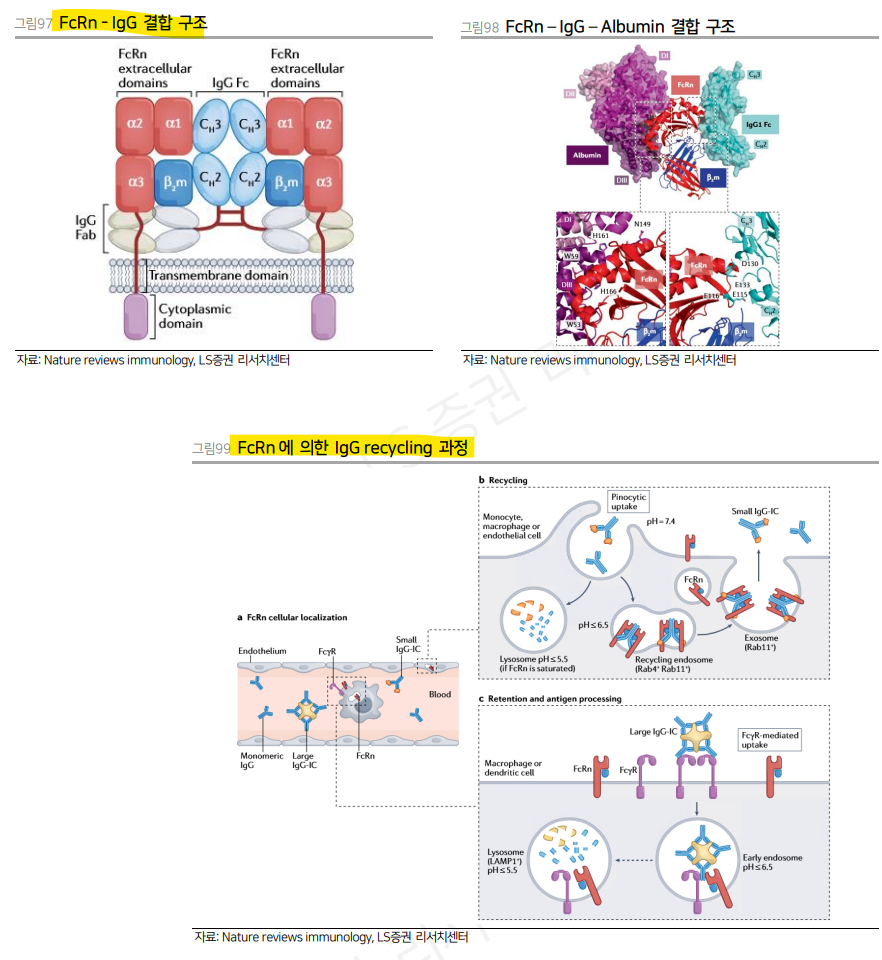 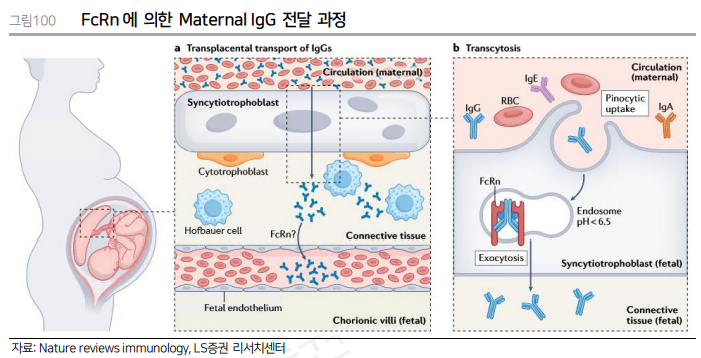 FcRn antagonist 개발 현황 체내 존재하는 Immunoglobulin 중 IgG가 차지하는 비중이 80%에 육박하는 것을 감안했 을 때 FcRn 차단을 통해 IgG의 반감기를 줄여 궁극적으로는 혈중 IgG 레벨을 낮추는 것 은 효과적인 전략이다. 개발 중인 FcRn antagonist 중 상용화 측면에서 가장 앞서 있는 것 은 Vybgart 이다. Argenx의 Vyvgart (Efgartigimod)는 인간 IgG1 fragment mutant 형태로 IV 제형으로 2022년 시장에 출시 되었다. MG 적응증으로 첫 승인 받은 뒤에 적응증 확장과 더불어 Hyaluronidase 기술을 적용한 SC 제형 개발을 완료하여 Vyvgart Hytrulo를 출시하였으며, PFS와 Autoinjector 개발 등 환자 편의성 개선을 위한 연구를 지속하고 있다. Vyvgart의 뒤를 이어 상업화에 성공한 것은 UCB의 Rystiggo (Rozanolixizumab)이다. SC infusion 형태로 투약되며, MG 적응증을 대상으로 2023년 시장에 출시되었다. 하지만 만성 두통 등의 부작용이 존재하며 높은 수준의 ADA가 발생하는 것으로 알려져 있다. J&J는 FcRn 항체인 Nipocalimab을 적극 개발하고 있다. J&J는 Nipocalimab이 타겟할 수 있는 질병이 잠재적으로 80개 정도 존재하는 것으로 판단하고 있으며 Rare autoantibody 질환, Marternal-Fetal 자가 면역 질환, Rheumatology 등의 거대 질환군에서도 적용 가능 할 것으로 판단하고 있다. 국내에서는 한올바이오파마(009420)가 이 분야의 선두 주자로 현재 MG, TED 등을 대상 으로 임상 3상 중에 있다.  ============== 중간 생략 ============== IRA 법안, 시밀러 침투의 가속화 미국 의료 보험 시스템 IRA에 법안의 배경과 그에 따른 영향을 이해하기 위해서는 미국 의료 보험 시스템과 의약품 유통 과정에 대한 이해가 선행되어야 한다. 미국에서 의약품의 유통은 제조사, 도매상, 도매상, 약국, 환자 그리고 PBM(Pharmacy Benefit Manager) 사이에 상당히 복잡하게 연결되어 있다. PBM(Pharmacy Benefit Manager)은 의약품 비용 관리와 약국 서비스 제공을 중개하는 회사이다. PBM은 건강보험사나 고용주 등과 계약을 맺어 처방약 혜택을 관리하고, 특정 약물의 사용을 제한하거나, 약품 목록(Formulary)을 설정한다. 미국의 3대 PBM은 전체 보험의 80%에 가까운 커버리지를 차지하고 있어 상당한 영향력을 가진다. PBM의 Formulary는 티어별로 분류되며 각 티어에 따라 환자가 부담하는 비용, Copay 또는 Coinsuarance가 달라진다. 즉 PBM이 약물을 Formulary에 등재하는지, 등재한다면 어떤 티어로 설정하느냐에 따라 환자의 접근성이 달라지고 이는 의약품의 매출과 연결된다. 제약사는 PBM에게를 회사가 개발한 약물이 더 많이 처방될 수 있도록 리베이트 또는 의약품 할인 등의 형태로 제공한다. 이러한 요소들로 인해 최종 소비자에게 제공되는 약가와 유통 단계별 이해 관계자들이 취득하는 약가는 상당히 큰 차이가 있다. 약가는 WAC(Wholesale Acquisition Cost)로부터 책정된다. WAC은 제약사가 도매 업체에게 의약품을 판매할 때 설정하는 도매 인수 가격이다. 이는 협상 전의 가격이며, 실제 거래에서는 리베이트나 할인이 적용되기 때문에 실제 판매 가격은 WAC보다 낮아진다. WAC는 PBM과 보험사 간의 협상에 출발점으로 사용된다. AMP (Average Manufacturer Price)는 제약사가 도매업체나 소매업체에게 제공한 의약품의 평균 판매 가격으로, Medicaid 프로그램에서 주로 참고 된다. AMP는 리베이트 계산에 중요한 기준이 되며, WAC보다 실제 판매 가격에 가깝게 책정된다. AWP (Average Wholesale Price)는 도매업체가 약국에 의약품을 판매할 때 참조하는 가격으로, 평균 도매가를 뜻한다. 실제 판매 가격보다는 높게 설정되며, 보험사와 PBM이 환자 부담금을 결정하는 데 기준으로 사용된다. AWP는 WAC보다 20~25% 더 높게 설정된다. ASP (Average Sales Price)는 주로 Medicare에서 참조되는 가격 지표로, 제약사가 도매업체에 실제로 판매한 평균 가격이다. 리베이트와 할인이 반영된 후의 가격으로, Medicare에서 환자에게 청구되는 금액의 기준이 된다. ASP는 실제 판매된 가격을 반영하므로 가장 현실적인 가격으로 간주된다. NADAC (National Average Drug Acquisition Cost)는 약국이 의약품을 실제 구매한 가격을 반영하는 가격 지표로, 주로 Medicaid에서 사용된다. NADAC는 리베이트와 할인을 포함하지 않은 약국의 실제 구매 가격을 나타내므로, 정부 프로그램에서 가격 투명성을 높이기 위해 사용된다.  IRA 법안은 바이오시밀러 침투를 가속화 메디케어 지출 지속 상승 중 미국의 의료 보험 시스템은 사보험과 공보험으로 나누어지며, 대다수의 미국인들은 직장을 통해 제공되는 사보험에 의존하고 있으며 나머지 인구는 공보험을 통해 의료 서비스를 보장받고 있다. 공보험은 주로 저소득층, 노인, 장애인을 대상으로 하며, 주요 공보험 프로그램으로는 Medicare와 Medicaid가 있다. Medicare는 65세 이상 또는 특정 장애를 가진 개인을 위한 연방 정부 주도의 보험 프로그램으로 파트 A~D로 구분된다. 파트 A는 입원 환자를 대상으로 기본 의료서비스를 커버하며, 파트 B는 외래 진료와 예방 서비스 등 포괄적인 의료서비스를 대상으로 한다. 주사제와 같이 병원에서 제공되는 특정 약물은 메디 케어 파트 B를 통해 보장 되며 ASP(Average Sales Price)를 기준으로 약가가 산정된다. 파트 D는 처방약 비용을 보장하는 부분으로, 의약품 가격과 밀접한 관련이 있다. 파트 D의 처방약 가격은 AMP(Average Manufacturer Price)를 기준으로 산정된다. 파트 C는 Medicare Advantage 프로그램으로 민간 보험사를 통해 추가적인 종합 의료 서비스를 보장 한다. Medicaid는 저소득층과 장애인을 대상으로 한 주정부와 연방정부가 공동으로 운영하는 의료보험 프로그램이다. 주별로 자격 요건과 혜택이 다르며, Medicaid는 기본적으로 무료이거나 매우 저렴한 비용으로 의료 서비스를 제공한다. IRA법안의 도입은 메디케어 지출의 지속적인 상승 추세를 배경으로 한다. 미국의 의료비용 지출은 꾸준히 상승해 왔으며 2032년까지 GDP 성장률을 상회할 것으로 전망한다. 2023년부터 2032년까지 연평균 GDP 성장률은 4.3%로 전망되는 데 반해, NHE (National Health Expenditure)는 5.6% 성장이 전망된다. 특히 메디케어를 통해 지출되는 의료비용의 증가가 가파르다. 메디케어 지출은 연평균 7.4% 성장할 것으로 전망하고 있는데 이는 메디케어 대상자의 증가 (2%)보다 인당 지출하는 의료비용의 증가(5.3%)가 더 큰 영향을 미칠 것으로 예상한다. 이러한 증가추세는 메디케이드나 사보험을 통해 지출 되는 의료 비용보다 더 가파른 수치이다. 미국은 의료 비용의 지속적인 상승을 심각한 문제로 인식하고 있으며 이에 IRA 법안 등을 통해 의료 비용을 낮추고자 한다.   IRA 법안 개요 IRA 법안은 5개의 항목을 골자로 한다. 첫째는 Medicare Part B, D 약가 인하이다. 26년 Part D 10개, 27년 Part D 15개, 28년 Part B/D 15개, 이후 Part B/D 20개. 대상 의약품은 저분자 의약품의 경우 미국 출시 이후 9년, 바이오 의약품은 13년 경과한 약물로 메디케어 파트 B, D에서 지출되는 약물 중 비중이 높은 약물들이 선정될 것이다. 단 제네릭 또는 바이오시밀러가 존재하거나 희귀의약품은 약가 인하의 대상이 되지 않는다. 두번째는 Inflation Rebate이다. 의약품 가격을 인플레이션율보다 이 인상할 경우, 초과분에 대해 제약사가 메디케어에 리베이트를 지급해야 한다. Part B는 ASP(Average Sales Price) 기준, Part D AMP (Average Manufacturing Price) 기준으로 산정된다. 세번째는 Part D Benefit Redesign으로 메디케어, 제조사, 환자, PBM의 부담금 비율이 조정된다. 환자 최대 부담금은 $2,000로 고정되고 PBM의 부담 비율이 늘어날 것이다. 마지막은 바이오시밀러 인센티브이다. 시밀러 처방시 처방자에게 제공하는 인센티브를 확대하는 정책으로 현행 ASP 기준 6% 에서 8%로 인상된다  약가 인하 지난 8월 15일 CMS (Centers for Medicare & Medicaid Services)는 IRA 법안에 따라 사전 선정된 의약품 10종에 대해 약가 할인율을 공개했다. 이에 따라 선정된 약물의 Medicare Part D List Price는 2026년부터 최대 79% 낮아지게 된다. CMS의 발표에 따르면 새로 협상된 가격은 2026년, Medicare에 60억 달러의 절감을 가져올 것으로 판단하고 있다. 산업계에서는 이에 따른 여파가 당장은 제한적이라는 입장이다. 이는 1)해당 약가 할인율은 예상치에 부합하는 수준 이었으며 2)관련 기업들은 약가 인하에 대비해 왔으며 3)선정된 약물 중 많은 것들이 이미 높은 경쟁으로 인해 List price보다 훨씬 낮은 가격에 판매되고 있기 때문이다. 하지만 여전히 장기적인 우려는 존재한다. 약가 인하 정책은 장기적으로 제약사의 수익성을 저하 시키는 요인이 될 수 있으며 특히 바이오 의약품 대비 저분자 화합물의 수명을 단축시키고 결과적으로 R&D를 저하할 수 있다. 개발사는 약가 인하에 의한 영향을 회피하기 위해 다양한 고민이 필요할 것으로 보인다. 약가 인하에 의한 영향을 막기 위해 약물의 출시 시점에 가격을 최대한 높게 설정할 가능성이 있다. 또한 제네릭/시밀러가 존재할 경우 약가 인하 대상에 해당되지 않는 점이 중요하다. 현재 오리지널 개발사는 물질 특허가 만료되더라도 다양한 특허를 통해 제네릭/바이오 시밀러의 조기 출시를 막고 있다. 하지만 약가 인하 대상을 피할 수 있다면 제네릭/시밀러 개발사와의 합의를 통해 조기 출시를 하는 것이 오히려 더 합리적인 선택일 수도 있을 것으로 보인다.  PART D Benefit Redesign Part D Benefit Redesign은 환자 최대 부담금은 $2,000로 고정되고 비용 지출이 늘어날수록 PBM의 부담 비율이 늘어나는 구조로 재조정된다. PBM 또한 같은 가격이 낮은 약물을 선호하게 될 것이고 결국 오리지널 약물 대비 바이오 시밀러의 시장 침투가 빨라질 것으로 전망한다.  |
* Best-in-class를 향해 한걸음씩 올라서다 - LS증권 (2024.09.26)
| IMVT-1402의 Best-in-class 잠재력 한올바이오파마에 대해 투자 의견 매수, 목표주가 53,000원으로 커버리지를 개시한다. 동사의 목표주가는 SOTP 방식으로 영업가치와 파이프라인 가치의 합으로 산정하였다. 파이프라인 가치는 임상 3상 진행 중이거나 가시화된 적응증에 대해서 미국, 유럽 시장에 대한 가치만을 산정하였다. FcRn antagonist는 자가 항체에 의한 질병 발병 과정이 명확한 자가 면역 질환에서 가장 촉망 받는 기전의 약물이다. IMVT-1402는 Batoclimab이 가지고 있는 Albumin 저하, 그로 인한 LDL 증가 부작용을 해소한 물질이기에 부작용으로 인해 고용량 유지에 우려가 있었던 Batoclimab과는 다르게 IMVT-1402는 고용량 유지가 가능할 것으로 보인다. 더불어 FcRn과의 결합 능력도 Batoclimab 대비 높다. 이 두가지 요소는 IMVT-1402의 IgG 감소능에 대한 기대감을 갖게 한다. 이미 IMVT-1402의 임상 1상에서 IgG 감소 결과는 80% 수준을 달성하며 경쟁력을 확인한 바 있다. 자가 항체에 의한 발병 기전이 명확한 질환에서 IgG 감소 정도와 임상적 증상 개선 정도는 상관 관계가 높으므로 IgG 감소 능력은 임상 성공에 있어 가장 핵심적인 부분이라고 할 수 있을 것이다. 자가 면역 질환의 특성상 환자 편의성은 중요한 차별 포인트이다. 시장 선두 주자인 Argenx 또한 Vyvgart SC를 출시하였으나 여전히 자가 투여는 불가능하고 이에 autoinjector 등을 개발 중이다. 자가 피하 주사가 가능한 FcRn 항체인 IMVT-1402는 상당한 이점을 갖는다. 종합해 보았을 때, 효력과 안전성, 투여 편의성 측면에서 IMVT-1402의 Best-in-class 잠재력을 기대해 볼만하다는 판단이다. 또한 선두주자가 공략하지 못한 적응증이 다수이기에 후발주자임에도 불구하고 Best-in-class 잠재력을 바탕으로 여전히 다수의 질환으로 진입이 가능하다. 아시아에서의 성과도 기대 동사의 중국 파트너사인 하버바이오메드는 지난 6월 중국 임상 결과를 바탕으로 Batoclimab의 중국 내 품목 허가를 위한 서류 제출을 완료했다. 이에 2025년 중증근무력증 치료제로 시장 출시가 된다면 매출액에 따른 로열티 수령을 기대해볼 수 있으며 추후 기업가치에 반영될 수 있을 것으로 판단한다. Valuation 한올바이오파마에 대해 투자 의견 매수, 목표주가 53,000원으로 커버리지를 개시한다. 동사의 목표주가는 SOTP (Sum of The Parts) 방식으로 영업가치와 파이프라인 가치를 반영한 비영업가치의 합으로 산정하였다. 파이프라인 가치는 임상 3상 진행 혹은 계획 중으로 상업화가 가시화된 적응증에 대해서 미국, 유럽 시장에 대한 가치만을 산정하였다. 각 파이프라인의 매출액 규모를 추정하는 데 있어 유병 환자수는 자료마다 큰 차이가 있으며 이에 보수적인 수치를 적용하였다. Batoclimab의 MG, TED 적응증은 2026년 미국 출시 후 2027년 유럽 출시를 가정하였으며, IMVT-1402는 2028년 미국 출시 후 2029년 유럽 출시를 가정하였다. 연간 치료 비용은 Vyvgart의 연간 치료비용을 반영하여 Batoclimab, IMVT-1402 모두 미국 $225,000로 가정하였으며, 유럽의 경우 50% 할인을 적용 하였다. 연간 약가 상승율은 3%를 가정 하였다. Batoclimab의 MG 타겟 환자군은 전체 MG 환자군 중 general MG 환자 80%, 이 중 AChR 양성인 환자 85%, 이 중 선행 치료 후 재발 환자 30%, Peak 시장 점유율은 10%로 가정하였다. TED 타겟 환자군은 전체 TED 환자군 중 Active moderate 및 severe 환자 40%, 이 중 선행 치료 후 재발 환자 30%로 가정하였으며 Peak 시장 점유율은 15%로 가정하였다. 모든 적응증에 대해 영구 성장률은 -10%를 가정하였다. IMVT-1402의 GD 타겟 환자군은 전체 GD 환자군 중 TED로 진행되는 환자 40%를 제외하고 이중 선행 치료 후 재발한 환자 비율 25%를 가정하였으며 이에 따른 환자 수는 Immunovant에서 분석하고 있는 타겟 환자수에 근접한다. Peak 시장 점유율은 25%로 가정하였다. GD의 경우 현재 선행 치료 실패시 적절한 대안이 없으며, 경쟁 약물 대비 진행상황이 빠르다. 모든 적응증에 대해 로열티 수입은 매출액의 12%로 가정하였으며 마일스톤에 대해서는 각각의 파이프라인에 대해 동일하게 나누어 추정하였다.    IMVT-1402: Best-in-class 잠재력 충분 동사는 2017년 FcRn 항체인 Batoclimab과 IMVT-1402(HL161ANS) 두개의 파이프라인에 대해 스위스 로이반트사에 총 계약 규모 $502M으로 기술 이전 하였다. 로이반트사의 자회사인 이뮤노반트사에서 현재 두 파이프라인에 대해 개발을 진행 중이다. 최근 이뮤노반트의 발표에 따르면 개발 단계에서 앞서 있는 Batoclimab보다 IMVT-1402에 조금 더 무게를 싣는 모습으로 보인다. Batoclimab은 현재 MG와 TED 임상 3상, CIDP 임상 2b상 진행 중이다. MG 3상결과는 1Q25, TED 3상 결과는 1H25 내 발표를 앞두고 있어 3상 결과에 따라 상업화 진행이 가능하다. 이와 함께 IMVT-1402의 개발 계획을 발표했는데 환자 규모 측면에서 상당히 큰 GD에 대해 Batoclimab 임상 2상 결과를 바탕으로 IMVT-1402 3상을 연내 개시할 계획이며, 1Q25 내 4개 적응증에 대해 임상 진입, 1Q26내 또 추가 적응증 5개에 대해 임상 진입을 계획 중에 있다. Batoclimab이 앞선 임상 결과들에서 가능성을 보여주었음에도 불구하고, Best-in-class 약물이 아니면 경쟁력이 떨어지는 자가면역질환 시장의 특성 상 시장 진입이 조금 늦어지더라도 Best-in-class 잠재력이 충분한 IMVT-1402로 빠른 전환을 시도하는 전략으로 판단된다. Batoclimab과 IMVT-1402 모두 FcRn 항체이지만 FcRn과의 결합 방식에 차이가 있어 IMVT-1402는 Batoclimab이 가지고 있는 Albumin 저하, 그로 인한 LDL 증가 부작용이 보이지 않는 물질이다. IMVT-1402 임상 1상 결과에서 부작용 또한 양호했다. 이미 승인을 받은 FcRn 항체인 UCB의 Rystiggo는 상당수의 환자에서 심각한 두통이 발견되고 있으며 이는 제한적인 시장 점유율을 보이는 원인 중 하나로 판단된다. 더불어 FcRn과의 결합 능력도 증가된 것으로 파악된다. IMVT-1402의 임상 1상에서 IgG 감소 결과는 80% 수준을 달성하며 경쟁력을 확인했다. 자가 항체에 의한 발병 기전이 명확한 질환에서 IgG 감소 정도와 임상적 증상 개선 정도는 상관 관계가 높으므로 IgG 감소 능력은 가장 핵심적인 부분이라고 할 수 있다. 자가 면역 질환의 특성상 장기 투여가 필수적이기에 환자 편의성은 상당히 중요한 차별화 포인트이다. 이에 시장 선두 주자인 Argenx 또한 Vyvgart SC를 출시하였으나 여전히 자가투여는 불가능하다. 최근 자가면역 질환 약물들은 SC 또는 경구 제형으로 개발되는 추세이며 유일하게 자가 피하 주사가 가능한 IMVT-1402는 상당한 이점을 갖는다. Batoclimab 또한 여전히 기회는 존재한다. IgG 감소 측면에서 경쟁력을 증명한 바 있으며 LDL 증가는 용량 및 투약 스케줄 변경 등으로 조절이 가능할 수 있을 것으로 보인다. 특히 Atorvastatin과의 병용을 통해 LDL 수치를 정상 수준으로 낮춘 결과는 Batoclimab 투약에 의한 LDL 증가가 관리 가능한 수준임을 뜻한다. 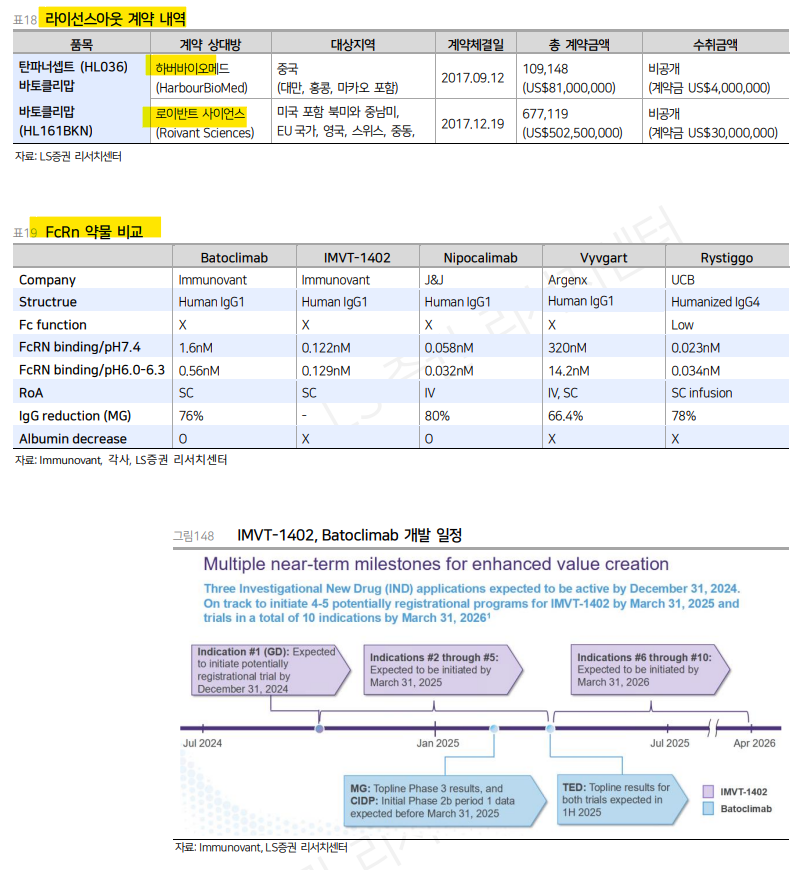   GD, 2상 결과에서 가능성 확인 GD는 갑상선 자극 호르몬 수용체(TSHR)에 대한 자가 항체 생성으로 나타나는 자가면역 질환으로, 이 자가항체들은 TSHR을 자극하여 갑상선 세포가 과도하게 호르몬을 분비하게 만든다. 환자들은 대개 고열, 빠른 심박수, 체중 감소, 불안감, 땀 분비 증가와 같은 다양한 증상을 경험하게 된다. GD는 갑상선 기능의 변화뿐만 아니라 환자의 삶의 질에 큰 영향을 미친다. 특히 TSHR 양성 환자에서 자가항체는 세포의 과도한 자극을 초래하고, 이로 인해 일부 환자들은 심각한 상태에 이를 수 있다. 대표적으로 GD는 Graves Orbitopathy(GO) 또는 Thryoid Eye Disease(TED)로 일컬어지는 외부 증상을 동반할 수 있으며, 이는 약 25~50%의 환자에서 발생하는 것으로 알려져 있다. 치료 방법으로는 항갑상선 약물(Antithyroid Drug, ATD)이 가장 널리 사용되지만, 이 약물은 간독성이나 알레르기 증상과 같은 부작용이 있을 수 있으며 특히 일부 환자에게서는 백혈구 감소증을 초래할 수 있어 큰 위험 요소로 작용한다. 방사선 요오드 약물의 경우 고형암 위험을 높이는 위험이 존재한다. 갑상선 절제술은 효과적일 수 있지만, 수술 후 목소리 변화, 부갑상선 기능 저하, 삶의 질 전하 등이 발생할 수 있어 선호되고 있지 않다. 또한 ATD 투약 후에 25~30% 환자에게서 재발이 발생하기 새로운 후속 치료법에 대한 니즈가 높은 상황이다. IMVT-1402는 이러한 상황에서 좋은 치료 옵션으로 자리잡을 수 있는 가능성을 가지고 있다. GD의 유병 환자는 데이터에 따른 차이가 있으나 미국의 경우 최소 800,000명에서 최대 2,500,000명에 이르고 유럽의 경우 최소 1,000,000명에서 최대 7,500,000명에 달하는 것으로 알려진 상당히 큰 질환이다. Immunovant의 분석에 따르면, Inovalon claims analysis 기준 미국 유병 환자는 약 880,000명으로 추정되며, 매년 65,000명의 신규 환자가 발생하고 있다. 이는 보험 청구 데이터를 기반으로 한 보수적인 추정치로 확인된다. Immunovant에서는 해당 데이터를 기반으로 하여 재발 환자 등을 분석해 보았을 때 최소 350,000명의 환자가 IMVT-1402의 타겟 환자 군이 될 것으로 분석하고 있다. 최근 발표된 Batoclimab 임상 2상 결과는 FcRn antagonist의 GD 적응증에서의 성공 가능성을 확인시켜 주었다. 해당 임상에서는 12주 동안 Batoclimab 680mg QW 투약 후 이어서 12주 동안 Batoclimab 340mg QW 투약했다. 첫 12주가 끝날 무렵, 임상 참가자들은 평균 77%의 IgG 감소를 경험하였고, ATD 증량 없이 T3 및 T4 수치가 정상 상한선 (Upper limit of normal, ULN) 이하로 떨어지는 76%의 반응률을 보였다. 두번째 12주 종료 시 평균 65%의 IgG 감소가 나타났으며, 반응률은 68% 수준 이었다. 가장 중요한 것은 IgG 감소와 임상적 개선의 상관 관계가 GD에서도 성립하는가이다. 임상 시험 종료 시점에서 최소 70%의 IgG 감소를 달성한 환자는 그렇지 않은 환자에 비해 ATD-Free Response 비율이 거의 3배 높았다(60% 대 23%). 이를 통해 GD에서도 IgG 감소와 임상적 개선의 상관 관계가 일부 입증 되었으며 이는 임상 1상에서 Batoclimab 수준의 IgG 감 소 능력을 증명한 IMVT-1402의 GD 임상 3상에서 성공적인 결과를 기대해볼 수 있는 근거가 된다.   TED: 치료제 존재하지만 unmetneeds 큰 질환 TED는 TSHR과 IGF-1R의 과도한 활성화에 의한 자가면역 질환이다. TSHR 활성화는 IGF-1R 신호를 증폭시킬 수 있으며 이에 GD 환자의 25~50%가 TED를 겪는다. 이러한 신호 전달 경로는 안와 섬유모세포에서 활성화되어 염증성 사이토카인과 하이알루론산을 분비하게 되고, 이로 인해 세포 간 공간에 체액이 축적된다. 결과적으로 눈알이 앞으로 밀려나게 되며, 이는 눈의 돌출과 다양한 증상으로 나타난다. TED의 초기 증상으로는 건조한 눈, 눈 뒤의 통증, 결막의 발적 및 부기, 그리고 시력 저하가 있으며, 질병은 일반적으로 2-3년 동안 지속되는 활성 단계와 그 이후의 비활성 단계로 진행된다. TED의 치료의 첫 번째 접근법은 환자가 정상적인 갑상선 기능을 유지하도록 돕는 것이다. 이를 위해 ATD, RIA, 갑상선 절제술 등이 사용된다. 해당 방법으로 개선이 되지 않는다면 면역 억제제나 바이오 의약품의 사용도 고려된다. 질병이 악화된 경우 안와 감압 수술이나외사근 수술과 같은 침습적인 치료가 필요할 수 있다. Tepezza(Teprotumumab)는 IGF-1R 항체로 TED에서 효과적인 결과를 보여주었다. Placebo 대비 2mm 이상의 안구 돌출 (Proptosis) 감소를 보인 환자의 비율이 Tepezza 투약군 83%, Placebo 10%였으며 시력, 안와 지방 부피 감소, 삶의 질 개선과 같은 2차 반응에서도 유의미한 개선을 보였다. 하지만 Tepezza의 경우, 장기 효력에 대한 불확실성뿐 아니라 청력 손실이 10% 가까이 나타날 수 있는 약물로 상당한 안전성 우려가 존재한다. TED 환자는 미국에서 최소 50,000명에서 200,000명, 유럽에서는 최소 30,000명에서 200,000명 정도로 추정된다. Argenx는 미국 기준 TED 환자를 100,000명으로 추정하고 있다. Immunovant의 분석에 따르면 TED환자는 Inactive TED 40%, Active-Mild 20%,Active-Moderate to Severe 40% 비율로 분류 된다. Active-Moderate to Severe 환자 중 Tepezza 투약을 하지 않은 5,000~7,000명, Tepezza 투약 후 증상이 존재하는 환자 3,000~11,000명 수준으로 추정하여 총 타겟 환자군은 8,000명~18,000명으로 제시한다.   MG, 임상 개선 측면에서 경쟁력 증명이 필요 MG는 골격근 약화가 특징인 자가면역 질환으로, 증상은 눈 근육 등 일부에 국한되거나 전신적으로 나타날 수 있다. 환자의 약 90%는 증상이 전신적으로 나타나는 generalized MG(gMG)로 진행된다. MG는 신경근 접합부에서 Acethylcholine 수용체(AChR), Muscle-specific receptor tyrosine kinase(MuSK) 등에 대한 자가 항체에 의해 발생하며, 이들 항체가 신경전달물질의 신호 전달을 방해한다. AChR 자가항체는 대표적인 원인으로 환자의 약 85%에서 발견된다. MG의 진행 및 심각도를 평가하기 위해 여러 척도가 사용되며, 그 중 MG Activities of Daily Living (MG-ADL) 척도가 가장 널리 사용된다. 이 지표는 환자를 대상으로 설문하여 여덟 가지 기능(말하기, 씹기, 삼키기 등)을 0-3의 척도로 평가한다. 추가적인 척도로는 QMG, MGC, MG-QOL15 등이 있으며, 각기 다른 측면에서 MG의 진행 및 심각도를 측정할 수 있다. 주요 치료법으로는 ACh Esterase inhibitor가 사용되며 이들은 아세틸콜린의 분해를 늦춘다. 그러나 대부분의 경우 기본적으로 면역억제 요법이 필요하며 코르티코스테로이드 등의 면역 억제 요법은 효과적이지만 장기적인 사용은 심각한 부작용을 유발할 수 있다. MG 환자는 미국 최소 약 40,000명에서 최대 100,000명까지 존재하는 것으로 추정되며 유럽에서는 MG 환자 수가 최소 75,000명에서 최대 200,000명으로 추정된다. Argenx는 미국에서 약 80,000명의 MG 환자가 있는 것으로 분석하고 있으며, Immunovant에서는 미국에는 약 65,000 명, 유럽에는 약 100,000 명의 MG 환자가 있는 것으로 판단한다. 이들 환자 중 약 80%는 평생 치료가 필요한 상태이며 스테로이드나 면역억제제 등 1차 치료를 받은 후 30~50%의 환자가 재발하거나 불충분한 효과를 보인다. Vyvgart와 Rystiggo와 같은 FcRn antagonist의 등장으로 MG 시장은 새로운 국면을 맞았으며 FcRn antagonist의 경쟁이 가장 치열한 분야이기도 하다. Vyvgart는 임상 3상에서 효과적인 MG-ADL 개선을 보여주었다. 3상 ADAPT 구에서 Responder를 최소 4주 연속으로 MG-ADL 점수가 2점 이상 개선된 환자로 정의하였을 때 1차 치료 싸이클 종료 후 Vyvgart 투약군에서는 68%, 위약군에서는 30%의 반응률을 확인하였다. Batoclimab의 경우 2상에서 통계적으로 유의미한 임상 개선을 보여주지 못했으며 중국 3상 결과는 Vyvgart에 미치지 못하는 효력을 보여준다. 현재 진행 중인 3상 결과에서 Vyvgart대비 경쟁력이 있는 결과를 보여줄 수 있을지 지켜볼 필요가 있겠다.    |
* 임상 2상 면제, 3상 진입 확정 - 신한투자증권 (2024.09.10)
| IMVT-1402 상업화 전단계 임상 바로 진입 파트너사 이뮤노반트가 IMVT-1402에 대해 임상 2상 없이 3상으로 바로 진입할 수 있음을 FDA로부터 확인 및 연말 진입하겠다고 밝혀 상업화 지연 우려 해소. 그레이브스병을 포함해 다양한 적응증 확장에도 속도가 붙을 수 있어 긍정적 IMVT-1402 그레이브스병 전세계 최초 신약 지난 2Q IMVT-1401의 임상 지연으로 주가 조정 중이었으나 금일 IMVT-1401의 그레이브스병(항진증) 2상 결과를 토대로 물질을 IMVT1402로 교체해 임상 2상없이 3상 진입 및 승인이 가능. FDA로부터 IND 승인되어 연내 임상 개시 예정 IMVT-1402는 추가 적응증 확장도 임상 2상 없이 진입 가능할 것으로 기대. 그레이브스병은 아직 치료제가 없고 경쟁사 아제넥스 또는 J&J이 타깃하지 못하는 적응증이어서 동종계열 내 최초, 최고 약물 기대 현재 1차 치료제인 ATD(항갑상선제) 처방 환자의 약 25-30% 시장 타깃(미국 약 33만명). 고용량 기준 IgG(자가항체) 감소가 -77% 및 76% 환자가 약물 반응 보임. 특히 고용량 투약 환자 56%가 더 이상 ATD를 복용하지 않아도 될 만큼 치료 효능 확인된 것 Valuation & Risk 경쟁사 아제넥스의 항FcRn 시장 독점이 당분간 유지될 것이나 아제넥스는 ITP, 천포창 확장을 실패. 금일 이뮤노반트 주가가 -7% 수준까지 하락했으나 적응증 확장 임상의 지속적 성공으로 경쟁력 입증. FDA 임상 2상 면제도 긍정적 평가  그레이브스병 임상 2상 주요 결과 그레이브스병은 갑상선 기능이 과잉되어 갑상선 호르몬이 과다하게 생성되는 자가면역질환이다. 아래 그림처럼 TSHR(갑상선자극호르몬 수용체)에 자가항체(Autoantibodies)가 결합해 갑상선호르몬(T3, T4) 호르몬이 과잉 분비된다.  이러한 과잉 생산은 항진증을 일으키며 체중 감소, 빠른 심장 박동, 피로, 체중 감소 그리고 갑상선암이나 심장병, 갑상선안병증같은 합병증을 초래하여 실명까지 갈 수 있다. 심혈관 합병증으로 인한 사망률이 23% 증가하고 주요 심혈관 사건 발생 위험이 2배 이상 증가하는 등 현재 치료제는 없으며 ATD(항갑상선제)를 처방하는 것이 최선이다. ATD(Anti-Thyroid Drug)는 현재 환자의 약 25~30%가 재발을 일으키거나 내성이 생기며 심각한 부작용도 유발한다. 또한 방사성 요오드 치료법은 15~33% 환자에서 갑상선안병증(TED) 환자가 발생되며 평생 갑상선호르몬을 투약해야 하는 불편함이 있다.   한올바이오파마가 원천 개발한 IMVT-1401가 전세계 유일 치료제로 동종계열 내 최초 약물(first-in-class)이자 동종계열 내 최고 약물(best-in-class)가 될 가능성이 높은 임상 결과가 금일 공개됐다. 바토클리맙(IMVT-1401)은 IgG 감소율에 따라 ATD 환자에게 반응을 비례하게 나타내었고 ATD의 복용량 증가 없이 T3, T4 수치를 정상까지 이뤄낸 비율을 반응율로 하였다. 12주차에서 680mg 고용량 투약환자들을 대상으로 76%의 환자가 반응을 보였으며 이 때 IgG 감소율 또한 77%가 확인되었다. 24주차까지는 340mg 저용량 투약환자들을 대상으로 68%의 환자가 반응을 보였으며 IgG 감소율 또한 65%로 약물 농도에 따라 비례하게 증감됨을 확인했다.  특히 주목할 만한 부분은 680mg 고용량 환자 56%에서 ATD 복용을 중단했음에도 불구하고 T3, T4 호르몬이 정상 수치를 유지했다는 점이다. 그리고 저용량 380mg을 투약한 환자는 36%의 환자가 ATD를 중단 후에도 T3, T4 호르몬 수치를 정상으로 유지했다. 이는 ATD 요법에 대한 잠재적 대체 가능성까지도 보여주는 부분이다. IgG가 70% 이상 감소된 환자들에서는 60%가 ATD 없이도 약물 반응을 효과적으로 보였다는 것이다. ATD 의존성을 줄였다는 점을 꼭 주목해서 보아야 한다.  안정성과 내약성에서도 좋은 결과를 보였다. 전체 TEAE(치료 중 발생한 이상반응)은 25명 중 25명 발생되었고 약물관련 심각한 TEAE를 경험한 환자는 0명으로 관찰되지 않았다. 갑상선 호르몬 관련 치료법이기 때문에 이상반응은 일반적인 것으로 간주한다.  IMVT-1402 임상 3상 바로 진입, 상업화 시점 당겨진다 이로써 IMVT-1402의 임상 3상 디자인까지 공개되었는데 IMVT-1401이 저용량에서 IgG 감소율과 반응율이 감소한 만큼 IMVT-1402는 고용량만 진행한다. 600mg을 ATD 12주 이상 복용한 환자들을 대상으로 26주 동안 피하주사(SC) 투약한다. 그리고 남은 26주 동안 반응 여부에 따라 위약으로 전환하는 일부 환자들을 관찰하여 비교하는 것이 목표이다. 1차 지표는 26주차 갑상선 기능 정상화 여부와 ATD 중단에 성공한 환자 비율이며, 2차 지표는 52주차 갑상선 기능 정상화 여부와 ATD 중단 비율, 그리고 안정성을 평가하는 것으로 발표됐다.  상업화 시 유일 약물 대체, 호라이즌보다 클지도 미국 약 33만명의 그레이브스병 환자가 존재하고 매년 6만 5천명의 신규 환자가 발생되며 약 25~30% 환자가 ATD에 재발되거나 또는 내성이 있는 상황으로 33만명이 있을 것으로 내다보고 있다.  2022년 암젠이 테페자(Tepezza)라는 갑상선안병증 치료제를 보유 중인 호라이즌을 인수합병할 때 가격이 무려 36조원 수준이었으며 2023년 매출액 약 20억 달러를 일으키고 있다. 출시한지 2년만에 갑상선안병증 기존 스테로이드를 처방하던 치료제 시장 20%를 점유했다. IMVT-1402가 임상 3상을 마무리하고 동종계열 최초 약물로 승인될 시 그레이브스병 하나의 적응증만으로 호라이즌의 가치를 받을 수 있을지 주목된다. 갑상선안병증은 그레이브스병 환자들의 합병증으로 시장이 훨씬 클 것으로 예상된다. 이뮤노반트가 경쟁사 아제넥스, J&J이 타깃하는 중증근무력증(MG), CIDP(다발성신경병증)이 아닌 차별화된 적응증으로 그레이브스병에 더욱 집중하는 이유로 보인다. 한올바이오파마의 상업화 전단계 임상으로 진입이 FDA로부터 승인된만큼 향후 적응증 확장 계획도 기대해볼 수 있겠다. |
* Immunovant의 첫번째 소식 - IM증권 (2024.09.10)
| GD 적응증 업데이트: Batoclimab 임상2a상 결과 + 1402 임상 계획 현지시각으로 9일 오전, 동사의 파트너사 Immunovant는 5월 말의 타임라인 변경 후 첫번째 업데이트를 통해 GD 적응증 임상2a상 결과와 IMVT-1402의 향후 임상 계획을 밝혔다. 탑라인 결과와 동일하게 IgG 감소와 임상적 이점이 동행한 결과는 FcRn 저해제 개발에 대한 PoC를 입증하였으며, 추가적인 GD 적응증의 역학 분석을 통해 타겟할 수 있는 환자군을 보다 구체적으로 제시했다. 1402의 허가를 위한 pivotal 임상2b상은 현재 IND 승인 상태로, 임상 진행 및 환자 등록을 위한 준비를 마친 후 올해 연말 시작될 예정이다. GD를 포함한 내분비계 질환의 신약 승인을 위해서는 2건의 유사한 pivotal 임상 결과가 필요하여 동사는 병렬적인 임상을 진행할 계획이다. GD: Best-in-Class만 들어올 수 있는 영역이 될 듯 Batoclimab의 임상2a상 세부 결과에 의하면, 고용량(680 mg)과 저용량(340 mg)에서의 IgG 감소율 차이가 임상적 효능의 유의미한 변화로 이어진다. 고용량을 투여한 첫 12주 동안은 평균 77%의 IgG이 감소, 저용량을 투여한 그 이후의 12주에는 65%의 IgG가 감소했으며, 이는 반응률(T3/T4 수치 정상화) 및 ATD 중단 환자의 비율 차이로 이어졌다. 현재 Batoclimab은 경쟁 FcRn 저해제 중 가장 우수한 IgG 감소능을 갖추고 있으며 유의미한 임상적 결과를 위해 큰 폭의 IgG 감소가 필요한 적응증에서 높은 점유율의 확보가 가능하다. 1402의 차례: GD 확증 임상2b 연내 시작, 연간 발생 환자수 ~20K Batoclimab의 PoC 입증 다음 계획은 1402의 확증(pivotal) 임상이다. ATD에 불응한 갑상선기능항진(hyperthyroid) 환자를 TSH 수치로 선별한 후, 투약군과 위약군으로 나누어 52주간의 약물 투여를 진행한다. 2a상의 결과에서 확인한 용량/효능 관계를 고려하여 2b상에서는 고용량(600 mg) 투여만 진행되며, 1차 평가 지표는 26주 시점에 ATD 약물 중단&갑상선 기능이 정상화된 환자의 비율이다. 이는 임상 성공의 기준을 높여 위약군과 1402 사이의 충분한 effect size를 활용하려는 계획으로 판단된다. 중간 발표 없이 맹검을 유지할 계획으로, 임상 결과 확인은 ‘26년, 승인을 위한 병렬의 추가 임상까지 고려하면 ‘27년 상업화가 예상된다. Immunovant의 분석에 의하면 1402가 타겟하는 미국 내 연간 발생 환자수(ATD 불응, 절제술 기피)는 전체 환자의 약 30%(~20,000명)이며, 유병 환자수는 약 33만명이다. 투자의견 Buy 유지, 목표주가 51,000으로 상향 동사에 대한 투자의견 Buy, 목표주가를 51,000원으로 상향한다. Immunovant에서 제시한 연간 발생 환자수를 반영하여 환자수를 소폭 조정하였으며, 보수적으로 유병 환자는 고려하지 않았다. 출시 시기 및 승인 확률은 기존의 가정과 동일, PoC 임상 세부 결과를 반영하여 FcRn 저해제의 TAM과 1402의 M/S을 상향 조정하였다. 재산출한 GD 적응증의 가치는 1.57조원이다(기존 1.22조원). 본 결과 발표에 대한 기대감으로 Immunovant의 주가는 지난 주 10% 이상 상승, 발표 후 -8% 하락하는 변동성이 확인되나, GD 적응증의 선제적 진입이 구체화된 긍정적인 임상 결과와 내년 상반기까지 존재하는 다수의 모멘텀을 근거로 매수 의견을 유지한다. |
* 그레이브스병, 최소 $2bn 이상의 매출 기대 - DS투자증권 (2024.09.10)
| IgG 감소율과 비례하는 효능 확인 ⇒ 경쟁사 방어 효과 이뮤노반트는 임상 2상에서 anti-FcRn의 그레이브스병 치료 효능은 IgG 감소율과 비례하며 약 70% 이상 IgG가 감소한 환자는 ATDs 중단율이 약 60%로 그 외 환자 약 23% 대비 큰 폭 증가함을 확인하였다. 현재 anti-FcRn의 경쟁사는 Argenx, J&J, UCB, 이뮤노반트(=한올바이오파마)다. IMVT-1402는 600mg 고용량 투여 시 약 74%의 IgG 감소 효능을 보이는 반면 경쟁사는 현재 임상에서 복용량 조절에 어려움을 겪고 있다. 따라서 70% IgG 감소율 진입장벽은 그레이브스병에서 경쟁사를 효과적으로 방어할 수 있는 수단이 될 것으로 판단한다. Pivotal trial은 IMVT-1402로,IND 승인 그레이브스병 Phase 2는 기존 바토클리맙으로 진행하나 허가용 임상은 IMVT1402로 전환하여 시행할 것임을 밝힌 바 있다. 이뮤노반트는 이번 컨퍼런스 콜에서 FDA로부터 IMVT-1402 pivotal trial에 대한 IND 승인을 최종 획득하였으며 올해 내 pivotal trial을 개시할 예정으로 밝혔다. IMVT-1402는 약 26~52주간 고용량 600mg를 투여할 예정이다. IMVT-1402 600mg IgG 감소율이 바토클리맙 680mg과 유사한 점을 감안할 때 향후 pivotal trial에서 약 60% 이상의 환자가 ATDs 중단하는 우수한 결과를 낼 것을 기대한다. 단, 승인을 받기 위해서는 총 2개의 pivotal trial이 필요할 것으로 전망된다. 난치성 그레이브스병은 임상 site 확보에 수 개월이 걸리는 점을 감안할 때 근 시일 내 추가 임상을 개시할 경우 2가지 임상에 대한 initial result 확인 시점은 ‘27년으로 예상한다. 출시 후 최소 약 $2bn 매출 달성 기대 이뮤노반트에 따르면 그레이브스병 환자들은 갑상선 절제를 회피하며 약물에 대한 선호가 높다. 이에 약 88만명의 유병환자 중 약 76만명이 항갑상선약물을 투여받으며 그 중 약 33만명은 재발함에도 불구하고 치료제가 없어 계속 항갑상선 약물을 투여하고 있으며 unmet needs가 높다. 그레이브스병 하위질환인 TED에서 Tepezza가 약 20%의 환자를 대상으로 출시 2년만에 약 $2bn의 매출을 올린 점을 감안할 때 IMVT-1402 역시 그레이브스병 단일 적응증에서만 최소 $2bn 이상의 매출을 달성할 수 있을 것으로 예상한다. 그레이브스병, IgG 감소율과 비례하는 효능 확인 70% 이상 IgG 감소 시, 효능 증가 확인 그레이브스병 치료; 70% 이상 IgG 감소능 요구 Anti-FcRn은 자가면역항체 중 약 75%에 해당하는 IgG의 recycling을 억제하는 기전을 통해 혈중 IgG 수치를 감소시켜 질병을 치료한다. 따라서 anti-FcRn에서 IgG 감소능은 치료 효능에 직접적인 영향을 미친다. 9월 9일 한올바이오파마의 파트너사 이뮤노반트는 컨퍼런스 콜을 통해 그레이브스병 임상 2상의 추가 데이터를 공유하였다. 우선 ATD-Free responder를 갑상선호르몬 수치가 정상화 혹은 정상 이하에 도달하여 항갑상선약물(ATDs)를 tapering 후 최종 중단한 환자로 정의하였다. 첫 12주간은 680mg 고용량을 투여한 뒤 이후 24주간은 340mg 저용량을 투여한 결과 24주차에 약 70% 이상 IgG 감소를 보인 환자들은 항갑상선약물(ATDs) responder 비율이 약 60%로 높은 반면 70% 미만의 낮은 IgG 감소율을 보인 환자는 약 23%만 ATDs를 중단하였다. 이뮤노반트는 그레이브스병으로 anti-FcRn이 사용되기 위해서는 약 50% 이상 ATD-free responder를 달성하여야 할 것으로 전망한다. 따라서 그레이브스병 적응증으로 개발하기 위해서는 약 70% 이상의 IgG 감소효능이 우선적으로 요구될 것으로 예상한다.  경쟁사 적응증 방어 효과 70% 이상 IgG 감소능 요구 ⇒ 경쟁사 진입 방어 Anti-FcRn은 현재 이뮤노반트, Argenx, J&J, UCB 등 총 4개사가 경쟁하고 있다. 이 중 현재 그레이브스병에 대한 임상을 진행하고 있는 회사는 한올바이오파마의 파트너사 이뮤노반트가 유일하다. 이뮤노반트가 PoC를 훌륭하게 입증하였기 때문에 경쟁사들 역시 그레이브스병에 진출을 시도할 것으로 예상된다. 그러나 이뮤노반트가 요구한 IgG 감소능은 경쟁자들을 효과적으로 방어할 수 있을 것으로 예상된다. 이뮤노반트는 그레이브스병의 치료제로 anti-FcRn을 개발하기 위해서는 최소 약 70% 이상의 IgG 감소 효능이 요구됨을 주장한다. 이 때 현재 유일하게 LDL 콜레스테롤 상승 이슈에서 자유로운 Argenx의 Vyvgart는 IV 약 66% 및 SC 약 62%의 IgG 감소 효능을 보임에 따라 그레이브스병 진출이 어려울 것으로 예상된다. 그 외 J&J의 nipocalimab 및 UCB의 rozanolixizumab은 알부민 저해를 통한 LDL 콜레스테롤 상승 이슈에서 자유롭지 않다. Nipocalimab은 최근 30mg/kg 및 60mg/kg 모두 알부민 감소를 확인하였다. J&J은 baseline의 일정 수준 이내로 알부민 감소를 유지시켰으며 전부 무증상임을 주장하고 있으나 이는 용량의존성 독성이 며 그레이브스병은 약 1년 이상의 장기 투여가 필요한 점을 감안할 때 필요 IgG 감소능을 보이는 60mg/kg까지 증량할 수 있을지 여부는 확인이 필요하다.  Pivotal trial은 IMVT-1402로, IND 승인 획득 IMVT-1402 전환 임상, IND 승인 획득 이뮤노반트는 ‘23년부터 그레이브스병 Phase 2는 기존 바토클리맙으로 진행하나 허가용 임상은 IMVT-1402로 전환하여 시행할 것임을 밝힌 바 있다. 이뮤노반트는 이번 컨퍼런스 콜에서 FDA로부터 IMVT-1402 pivotal trial에 대한 IND 승인을 최종 획득하였으며 올해 내 pivotal trial을 개시할 예정으로 밝혔다. 이를 토대로 CIDP에서 적응증 교체 전략 역시 큰 이변이 없을 경우 통과할 수 있을 것으로 전망한다. IMVT-1402는 기존 진행하였던 임상 2상과 달리 약 26~52주간 고용량 600mg를 투여할 예정이다. 26주간 600mg IMVT-1402를 투여한 뒤 TRab responder는 약을 중단하고 위약을 투여받아 52주간 약을 투여받는 Group 1과 비교할 예정이다.  IMVT-1402 임상 성공 가능성은? 매우 높다 바토클리맙은 임상 2상에서 IgG 감소율에 따른 그레이브스병 치료 효능을 입증하였다. 바토클리맙은 680mg 고용량 투여하는 12주 동안 약 76%의 환자가 반응하였으며 이 때 평균 IgG 감소율은 약 77%에 달하였다. 그러나 340mg 저용량을 투여하는 기간 12주간 반응률은 약 68%로 감소하였으며 환자의 평균 IgG 감소율도 약 65% 수준이었다. 이 때 각 군에서 갑상선 호르몬 정상화 및 항갑상선약물(ATDs) 중단을 달성한 환자의 비율은 각각 약 56%와 약 36%였다. 이뮤노반트는 ATDs 중단율 50%를 약물의 성공 기준으로 간주하고 있으며 이에 IgG 감소율 역시 70% 이상이 요구된다.  IMVT-1402는 ‘23년 진행한 임상 1상에서 600mg을 4주간 주 1회 반복 투여한 결과 약 74%의 IgG 감소를 나타내어 훌륭한 IgG 감소율을 입증하였다. 이는 바토클리맙 680mg 4주 투여 시 약 76% 감소와 유사한 수치이다. 그레이브스병 환자에서 바토클리맙을 680mg 고용량 투여하는 12주 동안 약 76%의 환자가 반응하였으며 이 때 평균 IgG 감소율은 약 77%에 달하였다. 그레이브스병 임상에서 저용량 340mg의 결과가 저조하였기 때문에 IMVT-1402 임상 2b상은 300mg 저용량을 시험하지 않고 고용량 600mg만 투여하는 임상으로 결정하였다. IMVT-1402는 LDL 콜레스테롤 상승 부작용이 없어 고용량을 오랜기간 투여하는 것에 자유롭다. 임상 1상 결과가 그레이브스병 Phase 2b에서도 재현될 경우 무난하게 IgG 감소율 70% 이상을 달성하여 이번 임상 2상의 결과를 재현할 수 있을 것으로 예상한다.  최종 임상 종료 시점은 2027년 전망 그레이브스병은 Pivotal trial 2개 요구 이번에 IMVT-1402가 IND 승인을 획득한 임상은 Pivotal trial에 해당한다. 그러나 이뮤노반트는 FDA는 그레이브스병에서 허가를 획득하기 위해서는 총 2개의 pivotal trial을 요구하고 있음을 밝혔다. 따라서 근 시일 내에 이뮤노반트는 그레이브스병에 대한 추가 허가용 임상을 시작할 예정이다. 단, 이뮤노반트는 공개된 pivotal trial과 추가 임상 시험을 동시에 마치기 위해 노력할 것임을 밝혔다. 임상 시험 사이트 구축에 시간 필요 그레이브스병은 최근에 임상시험이 매우 드문 질환 중 하나였다. 따라서 그레이브스병 전문의들은 최근 임상시험을 많이 진행하지 않았기 때문에 초기에 전문의를 교육시킬 필요가 있다. 따라서 임상 시험 개시 및 site 구축에 수 개월이 소요될 것으로 예상되나 일단 site를 구축하고 운영되기 시작하면 모수가 많은 그레이브스병 질환 특성상 다른 희귀질환 임상시험보다 훨씬 빨리 환자가 등록될 것으로 예상된다. 최종 임상 종료 시점은 2027년 전망 이뮤노반트는 IND 승인을 받은 pivotal trial에 대하여 올해 내 임상시험을 개시할 것으로 밝혔다. 그러나 각 site 당 20-25명을 모집할 예정으로 최소 10개 기관이 필요하며 기관 구축에 수개월이 소요될 것으로 전망되어 최종 환자 모집은 2026년까지 기간이 필요할 것으로 예상된다. 또한 환자를 약 52주간 관찰하여야 하기 때문에 임상 결과는 약 2027년 도출될 수 있을 것으로 전망된다. 출시 후 최소 약 $2bn 매출 달성 기대 그레이브스병 시장의 약 25-30% Target 높은 난치성 그레이브스병 Unmet needs 미국의 그레이브스병 치료는 점점 RAI(Radioiodine) 및 수술 대신 ATDs(항갑상선 호르몬의약품, Anti-thyroid Drugs)를 고려하는 추세다. 그러나 이 중 일부는 항갑상선약물에 대하여 내성이 있거나 재발하게 되며 이러한 경우 불편한 증상 및 의학적 위험(ex.갑상선 기능 항진 등)에 노출되게 된다. 이뮤노반트에 따르면 현재 약 85~90%의 환자들은 1st line treatment로 항갑상선약물을 투여받으나 그 중 약 25~30%의 환자들은 재발을 경험한다. 그럼에도 불구하고 이러한 환자들은 절제술을 거부할 경우 치료제가 없어 계속 항갑상선약물을 투여하고 있으며 unmet needs가 높다.  긴 투여 기간 = 보다 높은 매출 유도 그레이브스병 치료는 단기 유도 치료가 불가능한 질병이다. 따라서 미국 및 유럽의 guideline은 최소 18개월 이상 치료기간을 권장하고 있다. 또한 과거에는 약 12-18개월간 ATDs에 반응이 없는 환자의 경우 대부분 절제술을 받았으나 현재는 방사선 요법에 대한 거부감으로 절제술 보다는 긴 기간 약물요법을 선호하는 추세이다. IMVT-1402 반응 환자(=ATDs를 중단하였으며 T3/T4 수치가 정상화 된 환자)의 경우에도 완치 여부를 판단하기 이전에 약 1년 이상 IMVT-1402를 투여하여 자가면역항체를 억제해야 할 필요가 있다. 따라서 IMVT-1402의 임상시험 역시 최소 52주간을 관찰할 계획이며 top line data 역시 52주 후 관찰할 계획이다. 환자 당 최소 1년 이상의 투여 기간을 감안할 경우 환자 수 대비 IMVT-1402의 매출은 보다 높을 것으로 예상한다. Methimazole은 갑상선 호르몬 오버슈팅 유도 항갑상선약물 중 하나인 Methimazole은 직접 갑상선호르몬을 저해하며 therapeutic window가 매우 좁기 때문에 복용량에 따라 갑상선 항진증 환자를 갑상선 저하증으로 유도하기도 한다. 반면 anti-FcRn은 자가면역항체을 억제하는 기전으로 근본적인 질병 치료를 통해 갑상선호르몬의 정상화를 유도하기 때문에 난치성 그레이브스병에 대해 환자들과 의료진의 선호도가 높을 것으로 예상한다. 출시 후 최소 $2bn 매출 달성 전망 TED 치료제, Tepezza 출시 2년 후 $2bn 매출 달성 갑상선안병증(Thyroid Eye Disease, TED)로 불리우는 질환의 또 다른 이름은 그레이브스 안병증(Graves’ ophthalmopathy, GO)이다. 갑상선 수용체에 대한 자가면역항체의 생성으로 그레이브스병이 발병하며 이 중 안와 섬유아세포가 활성화 될 경우 갑상선 안병증이 발생한다. 2020년 TED 치료제 Tepezza가 출시되기 이전에는 일반적으로 스테로이드 전신 치료를 시행하였으며 이로 치료되지 않는 환자의 약 20%는 안와수술과 함께 2차 치료를 받았다. 이는 저렴한 약물과 수술이 혼재된 그레이브스 현재 시장과 매우 유사하다. 그레이브스병 역시 저렴한 항갑상선약물로 우선 치료를 시행하며 이로 치료되지 않는 환자는 절제술을 시행한다. Tepezza는 출시 이후 2년만에 약 20%의 Market share를 차지하였으며 순매출 약 $2bn을 달성하였다. 가격은 anti-FcRn과 Tepezza는 일반적으로 유사한 점을 감안하였을 때 target 환자 수는 그레이브스병이 약 33만명으로 Amgen이 밝힌 Tepezza 대상 환자 TED 약 10만명의 3배 수준으로 평가한다. IMVT-1402의 그레이브스병 적응증에서 매출을 보수적으로 최소 $2bn으로 예상하며 이는 $6bn 이상으로 성장할 수 있다.  |
* 진정한 Best-in-class를 위한 준비 - 미래에셋증권 (2024.08.08)
| 2Q24 Review: 영업손실 31억원(적전 YoY), 시장 기대치 하회 한올바이오파마의 2024년 2분기 매출액은 316억원으로 전년동기대비 24% 감소했다. 의약품 매출액은 281억원(+5% YoY)으로 바이오탑,엘리가드 등 주력 제품을 중심으로 판매가 확대되고 있다. 14분기 연속 전년동기 대비 성장 중이다. 하지만, 기술료 수익은 3억원(당사 추정치 19억원)을 기록하였다. 이는 주요 파이프라인 임상 일정 지연으로 이연인식 매출이 감소되었기 때문이다. 영업손실은 31억원이다. 전년동기 대비 97% 감소한 기술료의 영향이 가장 컸다. 이에 따라 매출총이익률이 66%에서 50%로 낮아졌다. 판관비는 전년동기대비 0.7% 감소한 185억원으로 전년동기와 유사했다. 목표주가 45,000원 및 투자의견 매수 유지 투자의견 매수,목표주가 45,000원 유지한다. 2024년 매출액 1,392억원(+3.2% YoY), 영업이익 2.1 억원(-90.5% YoY)으로 추정하였다. 영업이익 감소는 2분기 기술료 수익 감소 영향이 가장 크다. 하지만,바토클리맙 상업화 시,이익은 크게 증가 할 수 있을 것으로 판단된다. 2Q24 중국 바토클리맙 허가를 위한 BLA가 재제출되었다. 이에 따라 2025년 중국에서 바토클리맙에 대한 품목허가가 기대된다. 미국 파트너사인 이뮤노반트의 임상 전략 변경으로 바토클리맙 및 IMVT-1402의 임상 결과 발표 일정이 미뤄졌다. 이뮤노반트는 IMVT-1402에 더 집중하고 있으며, 이는 중장기적으로 좋은 판단으로 보인다. 경쟁사인 아르젠엑스는 바토클리맙과 기전이 유사한 비브가르트를 판매하고 있다. 따라서 동사는 Best-in-class인 제품을 출시하는 것이 중요하다. 바토클리맙의 경우 갑상선안병증 임상에서 콜레스테롤 증가에 대한 부작용이 확인된 바 있다. 따라서 대체 후보물질인 IMVT-1402가 더 좋은 대안일 수 있다. 바토클리맙의 25년 미국 상업화 기대감이 낮아졌으나,IMVT-1402의 가치가 부각될 수있을 것으로 보인다. 바토클리맙 및 IMVT-1402의 일본 및 한국 권리는 아직 한올바이오파마가 보유하고 있어 기술이전에 대한 기대도 남아있는 상황이다. 일본에서는 현재 중증근무력증 및 갑상선안병증에 대해 임상 3상 중이며,1Q27 품목 허가를 목표로 하고 있다. 한올바이오파마의 시가총액은 1.8조원으로,파트너사 이뮤노반트(시가총액 39억 달러) 대비도 저평가 받고 있다.     1. 이뮤노반트 2Q24 실적발표 주요 내용 이뮤노반트는 5월 29일 실적발표에서 IMVT-1402에 대한 수정된 전략을 발표하였다. 바토클리맙의 만성 염증성 탈수초성 다발성신경병증(CIDP) 및 중증근무력증(MG)에 대한 데이터 발표 일정을 변경하였다. CIDP 결과는 기존 2Q/3Q24에서 1Q25로,중증근무력증 결과는 기존 2H24에서 1Q25로 변경하였다. 중증근무력증의 경우,데이터에 따라 바토클리맙으로 최종 개발될 수도 있고 IMVT-1402로 대체될 수도 있다. 발표 후 이뮤노반트의 주가는 10.7% 하락하였으며,한을바이오파마는 2일 뒤 시점 5월 31일 큰 폭(-14.5%)으로 주가가 하락하였다. 주가 하락의 원인은 1) 바토클리맙의 첫 상업화(미국 기준) 시점으로 예상했던 25년이 불확실해진 점,2) R&D 비용 사용 기간이 늘어남에 따라 자금 조달에 대한 우려가 생긴 점 때문으로 보인다. 출시 시점이 미뤄진 것에 대한 아쉬움은 존재하나,중장기적인 관점에서는 더 좋은 전략으로 판단된다. 이뮤노반트는 바토클리맙과 IMVT-1402 중 더 경쟁력 있는 제품으로 첫 상업화 제품을 출시하려는 전략을 선택한 것으로 보인다. 경쟁사인 아르젠엑스는 바토클리맙과 기전이 유사한 비브가르트를 판매하고 있다. 따라서 동사는 제대로 된 Best-in-class인 제품을 출시하는 것이 중요하다. 바토클리맙의 경우 갑상선안병증 임상에서 콜레스테롤 증가에 대한 부작용이 확인된 바 있다. 따라서 대체 후보물질인 IMVT-1402가 더 좋은 선택일 수 있다. 후발주자인만큼 조금 더 빠른 출시보다는 ‘경쟁력있는 효능’에 집중하고자하는 전략으로 판단된다. 바토클리맙으로 진행 중인 그레이브스병 적응증에 대한 임상 2상 결과는 2H24 확인 가능할 것으로 보인다. 더불어 IMVT-1402로 진행할 임상 계획을 발표할 것으로 보인다. 이 또한 이뮤노반트가 IMVT-1402에 개발에 대한 강력한 의지를 갖는 것으로 보인다. 바토클리맙의 경우 First-in-class가 아니다. 따라서 바토클리맙 대비 더 효과가 좋은 IMVT-1402로 경쟁하는 것이 유리하다고 판단했을 것으로 보인다. IMVT-1402에 대한 3개의 IND 신청이 연말까지 진행될 예정이다. 또한,1Q25까지 IMVT-1402에 대한 4~5개의 적응증,1Q26까지 총 10개 적응증에 대한 임상시험을 시작할 것으로 발표하였다. 2. Argenx2Q24 실적발표 주요 내용 Argenx는 2024년 VYVGART에 대해 3개 적응증에 대한 임상 3상을 개시할 계획이다. VYVGART 임상의 경우 1) 갑상선안병증 임상은 이미 시작했으며,2) 쇼크렌증후군 임상 3상은 2상 개념 증명 연구에서 긍정적인 결과가 나온 후 연말 전에 시작될 것으로 예상된다. 3) 면역성 혈소판감소증(ITP) 적응증에 대한 소규모의 확증적 연구가 계획되어 있으며 연말 이전에 시작될 것으로 예상된다. 2Q24 VYVGART의 매출은 전년동기 대비 78% 증가한 4억 7,800만 달러를 기록하였다. A r g e n x는 6 월 2 1 일 만성 염증성 탈수초성 다발성신경병증(CIDP ) 적응증에 대해 VYVGART 판매 승인을 받았다. 바로 출시되었으며 3분기 CIDP 적응증에 대한 매출이 반영될 것으로 예상된다. 출시 14일 이내에 주요 목표의 25%를 달성하였으며,처방의 20%는 VYVGART의 신규 처방자에게서 나온 것으로 발표하였다. VYVGART Hytrul◦(피하주사제형)는 7월 초 중국에서 승인을 받았다. 미국의 경우 VYVGART Hytrulo 환자의 60%가 VYVGART 신규환자로 확인되었다.  |
* 대표이사 간담회 후기: 가시화된 일본 시장 - DS투자증권 (2024.07.12)
| 대표이사 간담회 후기: 가시화된 일본 시장 7월 11일, 한올바이오파마는 정승원 대표가 직접 국내외 애널리스트를 대상으로 기업의 중장기적 개발 전략 및 anti-FcRn 개발 현황을 소개하는 간담회를 진행하였다. 오픈이노베이션 전략을 위하여 미국 내 거주 중인 정승원 대표는 anti-FcRn 바토클리맙 및 HL161ANS(=IMVT-1402)의 일본 권리에 대한 공동개발 및 상업화를 위한 파트너십 논의를 위해 한국을 방문하였다. 한올바이오파마는 바토클리맙 및 HL161ANS(=IMVT-1402)에 대하여 글로벌 판권은 이뮤노반트에게 라이선스 아웃하였으며 중화권 권리는 하버바이오메드와 파트너십을 맺었다. 그 외 일본 및 한국은 현재 한올바이오파마가 권리를 보유하고 있으며 중증근무력증(MG, Myasthenia gravis)및 갑상선안병증(TED, Thyroid Eye Disease)에 대하여 직접 임상 3상을 진행하고 있다. 미국 이뮤노반트는 데이터에 따라 1402로 전환하고자 하여 출시시점이 불분명하나 한올바이오파마는 일본에서는 1402 전 환 없이 바토클리맙으로 빠르게 2027년 출시를 목표로 하고 있다. 각 임상은 내년 1분기 및 상반기에 top line 결과를 확보하여 ‘26년 1분기 J-NDA filing을 진행할 계획으로 ‘27년부터 본격적으로 시장에 진출할 것으로 예상된다. 바토클리맙 및 HL161ANS 일본 권리 가치, 최소 약 1.1조원 이상 보편적으로 일본은 글로벌 시장의 약 10%의 비중을 차지하는 것으로 알려져 있다. 따라서 한올바이오파마의 일본 권리는 ‘20년 8월 J&J이 중증근무력증 Phase 2 완료한 Momenta 인수 금액이 약 $6.5bn이었던 점을 감안하여 보수적으로 파이프라인 진행 가치 약 30% 할증, 약 10% 시장 비중을 적용하였을 때 최소 약 1.1조원 이상으로 전망한다. 바토클리맙이 니포칼리맙 대비 best-in-class를 기대하는 점, ‘20년은 anti-FcRn의 시장 확장성을 반영하기 이전인 점을 등을 감안할 때 보수적인 수치로 판단한다. 향후 파트너십은 파이프라인 가치를 반영하여 Upfront, 총 계약금, 로열티율을 조정할 것으로 예상된다. 일반적으로 로열티율은 매출 대비 현 R&D 지출액 비중에 따라 책정된다. 가령 연구개발비:마케팅 및 관리비의 비중을 1:3으로 가정한다면 OPM 40% 기준으로 licensor는 그 중 약 1/4인 10%, licensee는 3/4인 30%를 얻는 구조이다. 현재 한올바이오파마는 임상 3상을 두 가지 적응증에 대하여 진행하며 이미 많은 R&D 비용을 지출한 점을 감안하였을 때 높은 로열티율이 기대된다.  간담회 주요 내용 Q&A 세부내용 Q1. 제시해주신 2028년 Anti-FcRn의 시장 규모 9조원이 너무 작지 않은지에 대한 우려가 있다. A1. 현재 선두주자인 Argenx도 CIDP, MG 두 가지의 적응증에 대해서만 승인되었다. 2028년까지 anti-Fcrn이 개발 가능한 적응증이 fully approved 되지는 않을 것으로 예상된다. 개발 가능한 적응증에 적용된다면 anti-FcRn의 시장은 최종적으로 40조원이 넘을 것으로 예상한다. TNF-a inh 휴미라 역시 개발 초기에는 거대 파이프라인으로 생각하지 못하였다. Q2. 우리가 Best in class인 이유 A2. 우선 우리는 pure 한 자가주사가 가능하다. Argenx의 Vyvgart는 히알루로니다아제를 섞어 투약(*할로자임의 SC플랫폼 사용)하고 있으나 자가주사가 불가능하며 의료 진이 약 30분동안 환자를 관찰하여야 한다는 단점이 있다. UCB는 정확히는 피하주사가 아닌 약 15분간 피하주입(skin infusion)을 채택하여 자가주사가 불가능하다. 피하주사는 자가주사가 가능한지 여부가 가장 중요하다. 미국 보험회사들은 병원에 방문하지 않아도 되는 약을 우선 처방하도록 한다. Argenx와 UCB는 물성의 특성상 자가주사가 불가능한 파이프라인으로 판단한다. 더불어 바토클리맙과 ANS는 antibody suppression에 매우 효율적이며 2가지 용량으로 개발하여 환자의 상태에 따라 용량 조절이 가능하다는 추가적인 장점이 있다.  Q3. Batoclimab 상업화 일정 A3. 이뮤노반트에 따르면 현재 바토클리맙으로 Phase 3가 진행되고 있는 MG, TED 등은 데이터에 따라 바토클리맙으로 최종 개발될 수도 있고 IMVT-1402로 대체될 수도 있다. 그러나 한올바이오파마는 일본 시장은 바토클리맙으로 2027년 최종허가를 받는 것이 목표이다. Q4. 일본 기술이전 시 계약 조건이 어떻게 될지? A4. 일본 시장의 크기는 글로벌 시장의 약 10% 수준이다. 그러나 우리가 이뮤노반트에게 라이선스 아웃 했을 때에는 1상을 시작하였던 단계인 반면, 현재는 임상 3상을 종료하는 단계이기 때문에 더 큰 계약이 이루어질 것으로 예상한다. 로열티 및 마일스톤 역시 훨씬 클 수 있을 것으로 예상한다.  Q5. IMVT-1402(HL161ANS)가 백업 후보물질이었던 이유는? A5. 당시 SC 개발하기 위해 바토클리맙이 보다 적합한 물성을 보였다. 당시에는 anti-FcRn의 알부민 저해 효과에 대한 주의가 부족하였기 때문에 바토클리맙을 선정하였다. 이후 알부민 저해로 인한 LDL 콜레스테롤 상승 이슈가 발생하여 back up 후보물질을 탐색하여보니 ANS는 피하주사제형으로 제작하는 것에 물성상 문제가 없어 개발하게 되었다. Q6. 류마티스 관절염에 대한 경쟁사 data에 대한 개인적인 생각, 향후 진행? A6. 류마티스관절염 외에도 자가면역질환 중에서는 정확한 병인을 아직 모르는 질환이 많다. 이러한 질환들에서도 기회를 탐색해 볼 것이다. 예를 들어 다발성경화증은 B cell therapy를 통해 굉장한 치료효능을 보이기도 한다. 류마티스관절염은 경쟁사 nipocalimab 데이터를 보면 비교적 antibody 억제가 잘되지 않음에도 불구하고 데이터가 나쁘지 않았다. TNF-a inh 치료제를 사용한 이후 내성이 생긴 환자군에 투여될 것으로 예상된다. Nipocalimab은 높은 용량을 쓰지 못하였기 때문에 antibody 저해가 충분하지 못하였다. HL161ANS가 병원성 항체를 보다 높게 저해한다면 효능이 있을 기능성이 있다. Q7. 그 외 개발 중인 파이프라인에 대한 소개 A7. 대웅제약 인수 이후 기업 내부적으로 정리할 시간이 필요하였다. 4-5년 전부터는 기업이 정상화되어 파이프라인 개발 중에 있다. 연 내 새로운 프로그램을 발표할 수 있을 것으로 전망한다. |
반응형



